Антрациклин - Anthracycline

Антрациклины это класс наркотиков[2] используется в химиотерапия рака которые извлекаются из Streptomyces бактерия.[3] Эти соединения используются для лечения многих видов рака, в том числе лейкемии, лимфомы, грудь, желудок, матка, яичник, рак мочевого пузыря и рак легких. Первый обнаруженный антрациклин был даунорубицин (торговое название Дауномицин), который естественным образом производится Streptomyces peucetius, разновидность актинобактерии. Клинически наиболее важными антрациклинами являются: доксорубицин, даунорубицин, эпирубицин и идарубицин.[4]
Антрациклины являются одними из наиболее эффективных когда-либо разработанных противоопухолевых препаратов и эффективны против большего числа типов рака, чем любой другой класс химиотерапевтических агентов.[4][5][6] Их основные вредное влияние является кардиотоксичность, что значительно ограничивает их полезность. Также было показано, что использование антрациклинов в значительной степени связано с тяжелым или тяжелым циклом 1. фебрильная нейтропения.[7] Другие побочные эффекты включают рвоту.
Лекарства действуют, в основном, путем интеркаляции ДНК и вмешательства в метаболизм ДНК и производство РНК. Цитотоксичность в первую очередь связана с ингибированием топоизомераза II после того, как фермент вызывает разрыв ДНК, предотвращая повторноеперевязка разрыва и приводящего к гибели клеток. Основная структура антрациклинов представляет собой тетрациклическую молекулу с антрахинон скелет связан с сахарным фрагментом гликозидной связью. При захвате клеткой четырехкольцевая структура вставляется между парами оснований ДНК, в то время как сахар находится внутри малой бороздки и взаимодействует с соседними парами оснований.
История




Даунорубицин красный пигментированный препарат, который был открыт в начале 1960-х годов. Он был выделен из штамма Streptomyces peucetius Ди Марко и его коллеги из исследовательских лабораторий Farmitalia Research Laboratories в Италии назвали его дауномицином.[8] Примерно в то же время Дюбост и его коллеги во Франции также обнаружили это соединение и назвали его рубидомицином.[9] Даунорубицин был принят в качестве международного названия.[4] Первоначально было замечено, что он имеет активность против мышиный опухолей, а затем в клинических испытаниях было обнаружено, что он активен против лейкемия и лимфомы.
Доксорубицин был выделен из мутировавшего варианта S. Peucetius (var. цезий). Он отличается от даунорубицина только добавлением гидроксильной группы в положении углерода 14. Эта модификация значительно изменяет активность препарата, делая его высокоэффективным против широкого спектра солидных опухолей, лейкозов и лимфом. Это стандарт, по которому оцениваются новые антрациклины.[10][11][12][13][14]
Первые антрациклины были настолько успешными, что тысячи аналоги были произведены в попытках найти соединения с улучшенным терапевтическим применением. Только эпирубицин и идарубицин были приняты для использования во всем мире. Эпирубицин имеет сходную с доксорубицином активность, однако снижает кардиотоксические побочные эффекты.[15] Идарубицин представляет собой жирорастворимый вариант даунорубицина и является биодоступным при пероральном приеме.[4][16]
Несколько групп исследователей сосредоточились на разработке соединений, которые сохраняли бы полициклический ароматический хромофор антрациклинов (благоприятствуя интеркаляции в ДНК) и заменяли остаток сахара простыми боковыми цепями. Это привело к идентификации митоксантрона, который классифицируется как соединение антрацендиона и используется в клинике для лечения различных видов рака.[17] Было показано, что аналоги дисахаридов сохраняют противоопухолевую активность, и в настоящее время проводятся дополнительные исследования в отношении механизма их действия.[18]
Хотя с момента открытия антрациклинов прошло 50 лет и несмотря на недавние успехи в разработке таргетных методов лечения рака, около 32% пациентов с раком груди, 57% -70% пациентов с лимфомой пожилого возраста и 50-60% больных раком у детей. пациенты получают лечение антрациклинами.[19] Некоторые виды рака выигрывают от неоадъювантный Режимы на основе антрациклина, в том числе тройной негативный рак груди, который плохо поддается таргетной терапии из-за отсутствия доступных рецепторов, на которые можно воздействовать.[20] По сравнению с пациентами с не тройным отрицательным раком груди, пациенты с тройным отрицательным раком груди показали лучшую частоту ответа и более высокую частоту патологического ответа при использовании антрациклина, показателя, используемого для прогнозирования улучшенных долгосрочных результатов.[20]
Клинические испытания
Антрациклины остаются одними из наиболее широко используемых химиотерапевтических агентов, но их потенциал ограничен его дозоограничивающей токсичностью. В настоящее время проводится множество исследований по поиску антрациклинов с лучшей противоопухолевой эффективностью или со сниженными побочными эффектами с использованием различных систем доставки лекарств на основе нанотехнологий.[21][22][23][24]
Механизм действия
Антрациклины широко изучены на предмет их взаимодействия с клеточными компонентами и влияния на клеточные процессы. Это включает исследования на культивируемых клетках и на целых животных системах. В научной литературе задокументировано бесчисленное множество взаимодействий между лекарственными средствами и клетками, и они различаются в зависимости от свойств клеток-мишеней, доз лекарств и производимых промежуточных продуктов. Поскольку можно наблюдать артефактные механизмы действия,[26] Следующие механизмы, которые возникают при клинически значимых концентрациях лекарств, являются наиболее важными.
Интеркаляция ДНК
Антрациклины легко захватываются клетками и локализуются в ядро. Фрагмент хромофора антрациклинов выполняет интеркалирующую функцию и вставляется между соседними парами оснований ДНК.[26] Функция интеркалирования подавляет синтез ДНК и РНК в высоко реплицирующихся клетках, впоследствии блокируя процессы транскрипции и репликации.[26]
Яд топоизомеразы II
Это, безусловно, наиболее распространенный механизм для объяснения действия антрациклинов, поскольку токсичность, опосредованная топоизомеразой-II, проявляется при клинически значимых концентрациях лекарства.[18][26] Топоизомераза-II - это фермент, который создает временные разрывы двухцепочечной ДНК (дцДНК) и запечатывает их после устранения перекручивания Суперспирали ДНК. Антрациклины, интеркалированные в ДНК, образуют стабильный тройной комплекс антрациклин-ДНК-топоизомераза II, таким образом «отравляя» фермент и препятствуя повторному лигированию двухцепочечных разрывов ДНК.[27] Это опосредованное топоизомеразой-II повреждение ДНК впоследствии способствует остановке роста и задействует механизм репарации ДНК. Когда процесс восстановления не удается, возникают поражения. запрограммированная гибель клеток.[5]
Активные формы кислорода
Фрагмент хинона антрациклинов может подвергаться окислительно-восстановительным реакциям с образованием избыточного активные формы кислорода (ROS) в присутствии оксидоредуктивных ферментов, таких как редуктаза цитохрома Р450, НАДН-дегидрогеназа и ксантиноксидаза. Преобразование хинон Семихинон производит свободные радикалы, которые активно реагируют с кислородом с образованием супероксиды, гидроксильные радикалы и пероксиды.[28][29] Кроме того, клеточное железо катализирует окислительно-восстановительные реакции и дополнительно генерирует АФК.[28][29] Избыточные АФК, которые невозможно детоксифицировать, приводят к окислительному стрессу, повреждению ДНК и перекисное окисление липидов тем самым запуская апоптоз.[28][29]
Образование аддукта ДНК
Антрациклины также могут образовывать аддукты с ДНК посредством единственной ковалентной связи через аминальную связь от 3’-амино даунозамина к экзоциклической аминогруппе гуанина.[30] Подача внеклеточного формальдегида с использованием пролекарств, высвобождающих формальдегид, может способствовать образованию аддукта ковалентной ДНК. Такой аддукты было показано, что они блокируют специфические для GpC факторы транскрипции и вызывают апоптотические реакции.[30][31]
Клинические последствия
Результаты недавнего метаанализа свидетельствуют о том, что пациенты с раком груди либо с дупликацией центромеры 17, либо с аберрациями в TOP2A ген, кодирующий топоизомеразу-IIα, получает пользу от адъювантной химиотерапии, включающей антрациклины.[32] Это не включает подгруппы пациентов, у которых наблюдается амплификация HER2. Наблюдения этого исследования также позволяют идентифицировать пациентов, у которых антрациклины можно безопасно исключить из стратегий лечения.[32]
Побочные эффекты
Введение антрациклинов часто сопровождается побочными реакциями на лекарства, которые ограничивают использование антрациклинов в клиниках. Две основных токсичности антрациклинов, ограничивающих дозу, включают: миелосупрессия и кардиотоксичность. К счастью, введение терапевтических цитокинов позволяет контролировать миелосупрессию.[29][21] Следовательно, повреждение сердца остается основным недостатком противораковых средств на основе антрациклина.
Кардиотоксичность, опосредованная антрациклином, является дозозависимой и кумулятивной, при этом повреждение сердца возникает при самой первой дозе, а затем накапливается с каждым циклом антрациклина. Описано четыре типа кардиотоксичности, связанной с антрациклином.
| Виды кардиотоксичности | Время до презентации | Симптомы |
|---|---|---|
| Острый | Во время и сразу после приема препарата | Расширение сосудов, артериальная гипотензия, преходящие нарушения сердечного ритма |
| Субхронический | 1–3 дня после приема препарата | Перикардит-миокардит |
| Ранний хронический | Менее чем через 1 год после завершения лечения антрациклинами | Дилатационная кардиомиопатия, рестриктивная кардиомиопатия (редко), сократительная дисфункция левого желудочка, застойная сердечная недостаточность |
| Хроническое заболевание с отсроченным / поздним началом | Более 1 года после завершения лечения антрациклинами | Рестриктивная кардиомиопатия, дилатационная кардиомиопатия, застойная сердечная недостаточность |
В клинике устанавливается максимальная рекомендуемая кумулятивная доза антрациклинов для предотвращения развития застойных явлений. сердечная недостаточность.[34] Например, частота застойной сердечной недостаточности составляет 4,7%, 26% и 48% соответственно, когда пациенты получали доксорубицин в дозе 400 мг / м2.2, 550 мг / м2 и 700 мг / м2.[19] Следовательно, кумулятивное воздействие доксорубицина в течение жизни ограничено 400–450 мг / м3.2 чтобы снизить частоту застойной сердечной недостаточности до менее 5%, хотя у разных людей существуют различия в переносимости доксорубицина.[34] Факторы риска, которые влияют на степень сердечного повреждения, вызванного антрациклинами, включают генетическую изменчивость, возраст (младшие или старшие возрастные группы), предыдущее лечение кардиотоксическими препаратами и история сердечных заболеваний.[29] Дети особенно подвержены риску из-за активности антрациклина, которая может поставить под угрозу развитие незрелого сердца.[34]
Повреждение сердца, которое возникает в ответ на начальные дозы антрациклина, может быть обнаружено по увеличению тропонин уровень сразу после введения.[34] Биопсия также позволяет на ранней стадии выявить сердечное повреждение, оценивая изменения ультраструктуры сердца.[34] Получение кумулятивных доз антрациклина вызывает дисфункция левого желудочка и при продолжении дозирования достигает определенного порога, который может быть обнаружен клинически неинвазивный такие методы, как 2D эхокардиография и изображение скорости деформации. Достижения в разработке более чувствительных методов визуализации и биомаркеры позволяют раннее выявить кардиотоксичность и разрешить кардиозащитное вмешательство для предотвращения антрациклиновой кардиотоксичности.[34]
Преобладающая восприимчивость сердца к антрациклинам частично объясняется преимущественной локализацией антрациклинов в митохондриях. Это объясняется высоким сродством взаимодействия между антрациклинами и кардиолипином, фосфолипидом, присутствующим в митохондриальной мембране сердца, поскольку ткань сердца содержит относительно большое количество митохондрий на клетку.[29] Ткань сердца также имеет нарушенную защиту от окислительного стресса, показывая низкий уровень антиоксидантных ферментов, таких как каталаза и супероксиддисмутаза, для детоксикации антрациклин-опосредованных АФК.[29]
Механизмы, объясняющие повреждение сердца, вызванное антрациклином, сложны и взаимосвязаны. Впервые было признано, что это связано с окислительный стресс индуцируется антрациклинами.[29] Появилось более недавнее объяснение, согласно которому антрациклин-опосредованная кардиотоксичность связана с отравлением антрациклин-топоизомеразой IIb, что приводит к последующему окислительному стрессу.[35]
Чтобы уменьшить влияние сердечного повреждения в ответ на антрациклины, было изучено несколько кардиозащитных стратегий. Липосомальный составы антрациклинов (обсуждаемые ниже) были разработаны и используются для уменьшения сердечного повреждения.[36] Другие новые аналоги антрациклина, такие как эпирубицин и идарубицин, также предоставляют возможности для уменьшения неблагоприятных сердечных событий; эти аналоги не продемонстрировали более высокую противораковую активность по сравнению с исходными соединениями.[5][34] Альтернативный метод введения лекарств, включающий непрерывная инфузия в течение 72 ч по сравнению с болюсным введением обеспечивает некоторую защиту и может использоваться, когда ожидается получение высоких кумулятивных доз.[34]
Когда антрациклины вводятся внутривенно, это может привести к случайной экстравазации в местах инъекции. По оценкам, экстравазация заболеваемость колеблется от 0,1% до 6%.[37] Экстравазация вызывает серьезные осложнения для окружающих тканей с симптомами некроза тканей и изъязвления кожи.[37] Дексразоксан в основном используется для лечения антрациклинов после экстравазации, действуя как ингибитор топоизомеразы II, а также как хелатирующий агент для снижения окислительного стресса, вызванного антрациклинами.[37] Дексразоксан также с успехом использовался в качестве кардиопротекторного соединения в комбинации с доксорубицином у пациентов с метастатическим раком груди, которые получали более 300 мг / м3.2 доксорубицин, а также у пациентов, у которых ожидается положительный эффект от высоких кумулятивных доз доксорубицина.[38][36]
Нет доказательств высокого качества, подтверждающих эффективность кардиозащитных методов лечения.[39] Исследования кардиозащитной природы дексразоксана доказывают, что он может предотвратить повреждение сердца, не влияя на противоопухолевые эффекты лечения антрациклинами. У пациентов, получавших дексразоксан вместе с лечением антрациклином, был снижен риск сердечной недостаточности по сравнению с пациентами, получавшими антрациклины без дексразоксана. Однако на выживаемость не повлияло.
Радиоактивно меченый доксорубицин был использован в пилотном исследовании в качестве средства визуализации повреждений рака груди. Этот радиохимический, 99 мTc-доксорубицин, локализованный в опухолях молочной железы у пациентов женского пола, является потенциальным радиофармпрепаратом для визуализации опухолей молочной железы.[40]
В некоторых случаях антрациклины могут быть неэффективными из-за развития устойчивость к лекарству. Это может быть первичная резистентность (нечувствительный ответ на начальную терапию) или приобретенная резистентность (присутствующая после демонстрации полного или частичного ответа на лечение).[41] Устойчивость к антрациклинам включает множество факторов, но она часто связана со сверхэкспрессией трансмембранного белка оттока лекарств P-гликопротеина (P-gp) или белка множественной лекарственной устойчивости 1 (MRP1 ), который удаляет антрациклины из раковых клеток.[42][41] Большие исследовательские усилия были сосредоточены на разработке ингибиторов против MRP1 для повторной сенсибилизации антрациклинорезистентных клеток, но многие такие препараты потерпели неудачу во время клинических испытаний.[42]
Клинические составы на основе липосом
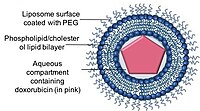

Липосомы представляют собой сферические фосфолипидные везикулы, которые могут быть образованы одним или несколькими липидными бислоями с фосфолипидами или холестерином.[44] Способность липосом инкапсулировать как гидрофобные, так и гидрофильные лекарственные соединения позволила липосомам быть эффективными системами доставки лекарств (DDS) для доставки ряда лекарств в этих наноносителях.[44]
Липосомальные составы антрациклинов были разработаны для поддержания или даже повышения терапевтической эффективности антрациклинов при одновременном снижении его ограничивающей токсичности для здоровых тканей, особенно кардиотоксичности. В настоящее время в клиниках доступны два липосомальных препарата доксорубицина.
Doxil / Caelyx - это первый одобренный FDA липосомальный DDS, который первоначально использовался для лечения больных СПИДом. Саркома Капоши в 1995 году и в настоящее время используется для лечения рецидивов рак яичников, метастатический рак груди с повышенным сердечным риском и множественная миелома.[45][21][46] Доксорубицин инкапсулирован в наноноситель, известный как Stealth или стерически стабилизированные липосомы, состоящий из однослойных липосом, покрытых гидрофильным полимером. полиэтиленгликоль (PEG), который ковалентно связан с фосфолипидами липосом.[47] Покрытие PEG служит барьером от опсонизация, быстрое выведение, в то время как лекарство стабильно удерживается внутри наноносителей за счет химического градиента сульфата аммония.[36][48] Основным преимуществом использования наноносителей в качестве системы доставки лекарств является способность наноносителей использовать протекающую сосудистую сеть опухолей и их нарушенный лимфатический дренаж посредством эффекта ЭПР.[49]
Максимальная концентрация свободного доксорубицина в плазме после введения доксорубицина существенно ниже по сравнению с обычным доксорубицином, что объясняет его низкий профиль кардиотоксичности.[36] Однако Доксил может вызвать Ладонно-подошвенная эритродизестезия (СИЗ, синдром кисти и стопы) из-за его накопления в коже. Доксил имеет более низкую максимально переносимую дозу (МПД) - 50 мг / м 2.2 каждые 4 недели по сравнению со свободным доксорубицином в дозе 60 мг / м2 каждые 3 недели.[36] Несмотря на это, максимальная кумулятивная доза Доксила все еще выше по сравнению с доксорубицином из-за его кардиозащитных характеристик.[47]
Миоцет - это еще один комплекс доксорубицина цитрата, инкапсулированный в непегилированные липосомы, одобренный для использования в сочетании с циклофосфамидом у пациентов с метастатическим раком груди в качестве лечения первой линии в Европе и Канаде. Доксорубицин загружается в липосомы непосредственно перед введением пациентам максимальной разовой дозой 75 мг / м 2.2 каждые 3 недели.[47] Myocet имеет такую же эффективность, как и традиционный доксорубицин, при этом значительно снижает сердечную токсичность.[50][51][52]
| Доксил | Миоцет | Рекомендации | |
|---|---|---|---|
| Состав липосом | ПЭГ-фосфолипид Фосфолипид Холестерин | Фосфолипид Холестерин | [36][53] |
| Размер | 80 нм - 100 нм | 150 нм - 250 нм | [54] |
| Метод загрузки лекарств | Градиент соли аммония | Градиент лимонной кислоты | [36][53] |
| Фармакокинетика | Дозировка: разовая доза 10 мг / м2 - 20 мг / м2 Пиковая концентрация в плазме: 7,4 мкМ - 15,3 мкМ[а] Период полувыведения: 50,2 ч - 54,5 ч[b] | Дозировка: разовая доза 60 мг / м2 Пиковая концентрация в плазме: 16 мкМ Период полувыведения: 16,4 ч.[c] | [36][55] |
| Клинические показания | Связанная со СПИДом саркома Капоши, рецидивирующий рак яичников и метастатический рак груди | Метастатический рак груди | [21] |
Неблагоприятные лекарственные взаимодействия
Лекарственные взаимодействия с антрациклинами могут быть сложными и могут быть связаны с действием, побочными эффектами или метаболизмом антрациклина. Лекарства, ингибирующие цитохром P450 или другие оксидазы, могут снижать клиренс антрациклинов, продлевая их циркуляцию. период полураспада которые могут увеличить кардиотоксичность и другие побочные эффекты.[56] Поскольку они действуют как антибиотики, антрациклины могут снизить эффективность таких обработок живыми культурами, как Бацилла Кальметта-Герена терапия рака мочевого пузыря.[57] Поскольку они действуют как миелосупрессоры, антрациклины могут снижать эффективность вакцин, подавляя иммунную систему.[58]
Некоторые взаимодействия имеют особое клиническое значение. Хотя дексразоксан можно использовать для смягчения кардиотоксичности или экстравазации антрациклинов, он также может снизить их эффективность, поэтому рекомендуется не начинать лечение дексразоксаном после первоначального лечения антрациклинами.[59] Трастузумаб (антитело HER2, используемое для лечения рака груди) может усиливать кардиотоксичность антрациклинов.[60][61] хотя взаимодействие можно минимизировать, установив интервал времени между антрациклином и трастузумаб администрация.[62] Таксаны (кроме доцетаксела) могут снижать метаболизм антрациклинов, повышая концентрацию антрациклинов в сыворотке крови.[63] Рекомендуется сначала лечить антрациклинами, если требуется комбинированное лечение таксанами.[57]
Смотрите также
Рекомендации
![]() Эта статья была адаптирована из следующего источника под CC BY 4.0 лицензия (2019 ) (отчеты рецензента ): «Антрациклины», WikiJournal of Медицина, 5 (1): 1, 6 декабря 2018 г., Дои:10.15347 / WJM / 2018.001, ISSN 2002-4436, Викиданные Q60638523
Эта статья была адаптирована из следующего источника под CC BY 4.0 лицензия (2019 ) (отчеты рецензента ): «Антрациклины», WikiJournal of Медицина, 5 (1): 1, 6 декабря 2018 г., Дои:10.15347 / WJM / 2018.001, ISSN 2002-4436, Викиданные Q60638523
- ^ Фредерик К.А., Уильямс Л.Д., Угетто Дж., Ван дер Марель Г.А., ван Бум Дж. Х., Рич А., Ван А. Х. (март 1990 г.). «Структурное сравнение комплексов противораковое лекарственное средство-ДНК: адриамицин и дауномицин». Биохимия. 29 (10): 2538–49. Дои:10.1021 / bi00462a016. PMID 2334681.
- ^ Тревор А.Дж., Кацунг Б.Г., Мастерс С.Б., Круидеринг-Холл М (2010). «Глава 54: Химиотерапия рака: антрациклиновые антибиотики». Фармакологический экзамен и рассмотрение совета. Нью-Йорк: McGraw-Hill Medical.
- ^ Фудзивара А., Хосино Т., Уэстли Дж. (1985). «Антрациклиновые антибиотики». Критические обзоры в биотехнологии. 3 (2): 133–157. Дои:10.3109/07388558509150782.
- ^ а б c d Weiss RB (декабрь 1992 г.). «Антрациклины: найдем ли мы когда-нибудь лучший доксорубицин?». Семинары по онкологии. 19 (6): 670–86. PMID 1462166.
- ^ а б c Минотти Дж., Менна П., Сальваторелли Э., Каир Дж., Джанни Л. (июнь 2004 г.). «Антрациклины: молекулярные достижения и фармакологические разработки в области противоопухолевой активности и кардиотоксичности». Фармакологические обзоры. 56 (2): 185–229. Дои:10.1124 / пр.56.2.6. PMID 15169927. S2CID 13138853.
- ^ Пэн Х, Чен Б., Лим СС, Сойер ДБ (июнь 2005 г.). «Кардиотоксикология антрациклиновых химиотерапевтических средств: перевод молекулярного механизма в профилактическую медицину». Молекулярные вмешательства. 5 (3): 163–71. Дои:10.1124 / миль 5.3.6. PMID 15994456.
- ^ Лайман Г. Х., Кудерер Н. М., Кроуфорд Дж., Вольф Д. А., Кулакова Е., Поневьерский М. С., Дейл, округ Колумбия (май 2011 г.). «Прогнозирование индивидуального риска нейтропенических осложнений у пациентов, получающих химиотерапию рака». Рак. 117 (9): 1917–27. Дои:10.1002 / cncr.25691. ЧВК 3640637. PMID 21509769.
- ^ Димарко А., Гаэтани М., Орецци П., Скарпинато Б. М., Сильвестрини Р., Солдати М., Дасдиа Т., Валентини Л. (февраль 1964 г.). "'Дауномицин - новый антибиотик группы родомицина ». Природа. 201 (4920): 706–7. Bibcode:1964Натура.201..706D. Дои:10.1038 / 201706a0. PMID 14142092. S2CID 4292271.
- ^ Dubost M, Ganter P, Maral R, Ninet L, Pinnert S, Preudhomme J, Werner GH (сентябрь 1964 г.). «Рубидомицин: новый антибиотик с цитостатическими свойствами». Отчеты о химиотерапии рака. 41: 35–6. PMID 14213139.
- ^ Arcamone F, Cassinelli G, Fantini G, Grein A, Orezzi P, Pol C, Spalla C (ноябрь 1969). «Адриамицин, 14-гидроксидауномицин, новый противоопухолевый антибиотик из S. peucetius var. Caesius». Биотехнологии и биоинженерия. 11 (6): 1101–10. Дои:10.1002 / бит. 260110607. PMID 5365804. S2CID 21897153.
- ^ Блюм Р. Х., Картер СК (февраль 1974 г.). «Адриамицин. Новый противораковый препарат со значительной клинической активностью». Анналы внутренней медицины. 80 (2): 249–59. Дои:10.7326/0003-4819-80-2-249. PMID 4590654.
- ^ Лечение рака у человека: химиотерапия, биологическая терапия, гипертермия и поддерживающие меры. Минев, Борис Р. Дордрехт: Springer. 2011 г. ISBN 9789048197040. OCLC 704395391.CS1 maint: другие (ссылка на сайт)
- ^ Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии. ДеВита, Винсент Т., мл., 1935-, Лоуренс, Теодор С., Розенберг, Стивен А. (8-е изд.). Филадельфия: Уолтерс Клувер / Липпинкотт Уильямс и Уилкинс. 2008 г. ISBN 9780781772075. OCLC 192027662.CS1 maint: другие (ссылка на сайт)
- ^ Такемура Г., Фудзивара Х (март 2007 г.). «Доксорубицин-индуцированная кардиомиопатия от кардиотоксических механизмов до лечения». Прогресс сердечно-сосудистых заболеваний. 49 (5): 330–52. Дои:10.1016 / j.pcad.2006.10.002. PMID 17329180.
- ^ Аркамоне Ф, Пенко С, Виджевани А (1975). «Адриамицин (NSC 123127): новые химические разработки и аналоги». Отчеты о химиотерапии рака. 6: 123–129.
- ^ Аркамоне Ф., Бернарди Л., Джардино П., Пателли Б., Марко А., Казацца А. М., Пратеси Г., Реджиани П. (июль 1976 г.). «Синтез и противоопухолевое действие 4-деметоксидаунорубицина, 4-деметокси-7,9-диэпидаунорубицина и их бета-аномеров». Отчеты о лечении рака. 60 (7): 829–34. PMID 1009518.
- ^ Evison BJ, Sleebs BE, Watson KG, Phillips DR, Cutts SM (март 2016 г.). «Митоксантрон - больше, чем просто еще один яд топоизомеразы II». Обзоры медицинских исследований. 36 (2): 248–99. Дои:10.1002 / med.21364. PMID 26286294.
- ^ а б Маринелло Дж, Делькуратоло М, Капранико Джи (ноябрь 2018 г.). «Антрациклины как яды топоизомеразы II: от ранних исследований к новым перспективам». Международный журнал молекулярных наук. 19 (11): 3480. Дои:10.3390 / ijms19113480. ЧВК 6275052. PMID 30404148.
- ^ а б McGowan JV, Chung R, Maulik A, Piotrowska I., Walker JM, Yellon DM (февраль 2017 г.). «Антрациклиновая химиотерапия и кардиотоксичность». Сердечно-сосудистые препараты и терапия. 31 (1): 63–75. Дои:10.1007 / s10557-016-6711-0. ЧВК 5346598. PMID 28185035.
- ^ а б Вахба Х.А., Эль-Хадаад Х.А. (июнь 2015 г.). «Современные подходы к лечению тройного отрицательного рака груди». Биология и медицина рака. 12 (2): 106–16. Дои:10.7497 / j.issn.2095-3941.2015.0030. ЧВК 4493381. PMID 26175926.
- ^ а б c d Cagel M, Grotz E, Bernabeu E, Moretton MA, Chiappetta DA (февраль 2017 г.). «Доксорубицин: нанотехнологические обзоры от скамьи до постели». Открытие наркотиков сегодня. 22 (2): 270–281. Дои:10.1016 / j.drudis.2016.11.005. PMID 27890669.
- ^ Пун RT, Борис Н. (февраль 2009 г.). «Лизотермочувствительный липосомальный доксорубицин: новый подход к повышению эффективности термической абляции рака печени». Мнение эксперта по фармакотерапии. 10 (2): 333–43. Дои:10.1517/14656560802677874. PMID 19236203. S2CID 73112213.
- ^ Мукаи Х., Когава Т., Мацубара Н., Наито Ю., Сасаки М., Хосоно А. (июнь 2017 г.). «Первое исследование фазы 1 на людях полимерных мицелл, конъюгированных с эпирубицином (K-912 / NC-6300), у пациентов с запущенными или рецидивирующими солидными опухолями». Новые исследуемые препараты. 35 (3): 307–314. Дои:10.1007 / s10637-016-0422-z. PMID 28054329. S2CID 596267.
- ^ Нишияма Н., Мацумура Ю., Катаока К. (июль 2016 г.). «Разработка полимерных мицелл для борьбы с трудноизлечимыми видами рака». Наука о раке. 107 (7): 867–74. Дои:10.1111 / cas.12960. ЧВК 4946707. PMID 27116635.
- ^ Гуо Б., Там А., Санти С.А., Париссенти А.М. (сентябрь 2016 г.). «Роль аутофагии и секвестрации лизосомальных лекарств в приобретенной устойчивости к доксорубицину в клетках MCF-7». BMC Рак. 16 (1): 762. Дои:10.1186 / s12885-016-2790-3. ЧВК 5043608. PMID 27687594.
- ^ а б c d Гевиртц Д.А. (апрель 1999 г.). «Критическая оценка механизмов действия, предложенных для противоопухолевых эффектов антрациклиновых антибиотиков адриамицина и даунорубицина». Биохимическая фармакология. 57 (7): 727–41. Дои:10.1016 / S0006-2952 (98) 00307-4. PMID 10075079.
- ^ Бинаски М., Бигиони М., Чиполлоне А., Росси С., Госо С., Магги Калифорния, Капранико Г., Анимати Ф. (август 2001 г.). «Антрациклины: избранные новые разработки». Современная лекарственная химия. Противораковые средства. 1 (2): 113–30. Дои:10.2174/1568011013354723. PMID 12678762.
- ^ а б c Ангсутарарукс П., Луанпитпонг С., Иссарагрисил С. (2015). «Кардиотоксичность, вызванная химиотерапией: обзор роли окислительного стресса». Окислительная медицина и клеточное долголетие. 2015: 795602. Дои:10.1155/2015/795602. ЧВК 4602327. PMID 26491536.
- ^ а б c d е ж грамм час я Симонек Т., Стерба М., Попелова О., Адамцова М., Хрдина Р., Герсл В. (январь 2009 г.). «Кардиотоксичность, вызванная антрациклином: обзор исследований, изучающих роль окислительного стресса и свободного клеточного железа». Фармакологические отчеты. 61 (1): 154–71. Дои:10.1016 / S1734-1140 (09) 70018-0. PMID 19307704.
- ^ а б Каттс С.М., Рефаэли А., Нудельман А., Угаренко М., Филлипс Д.Р. (2015). «Потенциальные терапевтические преимущества доксорубицина при активации формальдегидом для функционирования в качестве агента, образующего аддукт ДНК». Актуальные темы медицинской химии. 15 (14): 1409–22. Дои:10.2174/1568026615666150413154512. PMID 25866273.
- ^ Каттс С.М., Нудельман А., Рефаэли А., Филлипс Д.Р. (февраль 2005 г.). «Сила и потенциал аддуктов доксорубицин-ДНК». IUBMB Life. 57 (2): 73–81. Дои:10.1080/15216540500079093. PMID 16036566.
- ^ а б Бартлетт Дж. М., МакКонки С. С., Манро А. Ф., Десмед С., Данн Дж. А., Ларсимонт Д. П. и др. (Май 2015 г.). «Прогнозирование преимущества антрациклина: TOP2A и CEP17 - не только, но также». Журнал клинической онкологии. 33 (15): 1680–7. Дои:10.1200 / JCO.2013.54.7869. PMID 25897160.
- ^ Скалли Р. Э., Липшульц С. Е. (2007). «Кардиотоксичность антрациклина у лиц, длительное время переживших онкологические заболевания у детей». Сердечно-сосудистая токсикология. 7 (2): 122–8. Дои:10.1007 / s12012-007-0006-4. PMID 17652816. S2CID 834412.
- ^ а б c d е ж грамм час Эвер М.С., Эвер С.М. (сентябрь 2015 г.). «Кардиотоксичность противоопухолевых средств». Обзоры природы. Кардиология. 12 (9): 547–58. Дои:10.1038 / nrcardio.2015.65. PMID 25962976. S2CID 9317756.
- ^ Vejpongsa P, Yeh ET (январь 2014 г.). «Топоизомераза 2β: многообещающая молекулярная мишень для первичной профилактики кардиотоксичности, вызванной антрациклином». Клиническая фармакология и терапия. 95 (1): 45–52. Дои:10.1038 / clpt.2013.201. PMID 24091715.
- ^ а б c d е ж грамм час Габизон А, Шмида Х, Баренхольц Й (2003). «Фармакокинетика пегилированного липосомального доксорубицина: обзор исследований на животных и людях». Клиническая фармакокинетика.. 42 (5): 419–36. Дои:10.2165/00003088-200342050-00002. PMID 12739982. S2CID 29494837.
- ^ а б c Джордан К., Белендорф Т., Мюллер Ф., Шмоль Х. Дж. (Апрель 2009 г.). «Травмы, вызванные экстравазацией антрациклинов: лечение дексразоксаном». Терапия и управление клиническими рисками. 5 (2): 361–6. Дои:10.2147 / tcrm.s3694. ЧВК 2697522. PMID 19536310.
- ^ Чжоу Х, Лин Х, Лю Дж. М. (2015-07-13). "История двух ПЭГилированных липосомальных доксорубицинов". ОнкоЦели и терапия. 8: 1719–20. Дои:10.2147 / OTT.S79089. ЧВК 4508070. PMID 26203262.
- ^ ван Дален ЕС, Карон Х.Н., Дикинсон Х.О., Кремер ЛК (июнь 2011 г.). «Кардиопротективные вмешательства для онкологических больных, получающих антрациклины». Кокрановская база данных систематических обзоров (6): CD003917. Дои:10.1002 / 14651858.cd003917.pub4. ЧВК 6457676. PMID 21678342.
- ^ Араужо FI, Proença FP, Ferreira CG, Ventilari SC, Rosado de Castro PH, Moreira RD, Fonseca LM, Souza SA, Gutfilen B (август 2015 г.). «Использование (99m) сцинтиграфии Tc-доксорубицина у женщин с раком груди: пилотное исследование». Британский журнал радиологии. 88 (1052): 20150268. Дои:10.1259 / bjr.20150268. ЧВК 4651371. PMID 26111270.
- ^ а б Перес Э.А. (март 2009 г.). «Воздействие, механизмы и новые стратегии химиотерапии для преодоления устойчивости к антрациклинам и таксанам при метастатическом раке молочной железы». Исследования и лечение рака груди. 114 (2): 195–201. Дои:10.1007 / s10549-008-0005-6. PMID 18443902. S2CID 7302079.
- ^ а б Арнасон Т., Харкнесс Т. (октябрь 2015 г.). «Развитие, поддержание и изменение множественной лекарственной устойчивости: на перекрестке TFPI1, ABC Transporters и HIF1». Рак. 7 (4): 2063–82. Дои:10.3390 / раки7040877. ЧВК 4695877. PMID 26501324.
- ^ Fan Y, Zhang Q (апрель 2013 г.). «Разработка липосомальных препаратов: от концепции до клинических исследований». Азиатский журнал фармацевтических наук. 8 (2): 81–87. Дои:10.1016 / j.ajps.2013.07.010.
- ^ а б Серкомб Л., Веерати Т., Мохеймани Ф., Ву С.И., Суд А.К., Хуа С. (01.12.2015). «Достижения и проблемы доставки лекарств с помощью липосом». Границы фармакологии. 6: 286. Дои:10.3389 / fphar.2015.00286. ЧВК 4664963. PMID 26648870.
- ^ Баренхольц Y (июнь 2012 г.). «Доксил® - первый нанопрепарат, одобренный FDA: извлеченные уроки». Журнал контролируемого выпуска. 160 (2): 117–34. Дои:10.1016 / j.jconrel.2012.03.020. PMID 22484195.
- ^ Удрайн А., Скубиц К.М., Northfelt DW (2007). «Пегилированный липосомальный доксорубицин в лечении саркомы Капоши, связанной со СПИДом». Международный журнал наномедицины. 2 (3): 345–52. ЧВК 2676669. PMID 18019833.
- ^ а б c Соломан Р., Габизон А.А. (февраль 2008 г.). «Клиническая фармакология липосомальных антрациклинов: фокус на пегилированном липосомальном доксорубицине». Клиническая лимфома и миелома. 8 (1): 21–32. Дои:10.3816 / CLM.2008.n.001. PMID 18501085.
- ^ Харан Г., Коэн Р., Бар Л.К., Баренхольц Ю. (сентябрь 1993 г.). «Трансмембранные градиенты сульфата аммония в липосомах производят эффективное и стабильное улавливание амфипатических слабых оснований». Biochimica et Biophysica Acta (BBA) - Биомембраны. 1151 (2): 201–15. Дои:10.1016/0005-2736(93)90105-9. PMID 8373796.
- ^ Маэда Х., Накамура Х., Фанг Дж. (Январь 2013 г.). «Эффект EPR для доставки макромолекулярных лекарств к солидным опухолям: улучшение поглощения опухолью, снижение системной токсичности и четкая визуализация опухоли in vivo». Расширенные обзоры доставки лекарств. 65 (1): 71–9. Дои:10.1016 / j.addr.2012.10.002. PMID 23088862.
- ^ Батист Г (2007). «Сердечная безопасность липосомальных антрациклинов». Сердечно-сосудистая токсикология. 7 (2): 72–4. CiteSeerX 10.1.1.529.9071. Дои:10.1007 / s12012-007-0014-4. PMID 17652807. S2CID 2815965.
- ^ Батист Дж., Бартон Дж., Чайкин П., Свенсон С., Уэллс Л. (декабрь 2002 г.). «Myocet (инкапсулированный в липосомы цитрат доксорубицина): новый подход в терапии рака груди». Мнение эксперта по фармакотерапии. 3 (12): 1739–51. Дои:10.1517/14656566.3.12.1739. PMID 12472371. S2CID 46242391.
- ^ Леонард Р.С., Уильямс С., Тулпуле А., Левин А.М., Оливерос С. (август 2009 г.). «Улучшение терапевтического индекса антрациклиновой химиотерапии: акцент на липосомальный доксорубицин (Myocet)». Грудь. 18 (4): 218–24. Дои:10.1016 / j.breast.2009.05.004. PMID 19656681.
- ^ а б Свенсон CE, Перкинс WR, Робертс P, Janoff AS (июнь 2001 г.). «Липосомная технология и разработка Myocet ™ (липосомальный цитрат доксорубицина)». Грудь. 10: 1–7. Дои:10.1016 / S0960-9776 (01) 80001-1.
- ^ Bulbake U, Doppalapudi S, Kommineni N, Khan W. (март 2017 г.). «Липосомальные препараты в клиническом использовании: обновленный обзор». Фармацевтика. 9 (2): 12. Дои:10.3390 / фармацевтика9020012. ЧВК 5489929. PMID 28346375.
- ^ Мросс К., Ниманн Б., Массинг Ю., Древс Дж., Унгер С., Бхамра Р., Свенсон К.Э. (декабрь 2004 г.). «Фармакокинетика липосомального доксорубицина (TLC-D99; Myocet) у пациентов с солидными опухолями: открытое исследование однократной дозы». Химиотерапия и фармакология рака. 54 (6): 514–24. Дои:10.1007 / s00280-004-0825-у. PMID 15322827. S2CID 24630910.
- ^ Kivistö KT, Kroemer HK, Eichelbaum M (декабрь 1995 г.). «Роль ферментов цитохрома P450 человека в метаболизме противоопухолевых агентов: значение для лекарственного взаимодействия». Британский журнал клинической фармакологии. 40 (6): 523–30. Дои:10.1111 / j.1365-2125.1995.tb05796.x. ЧВК 1365206. PMID 8703657.
- ^ а б «Информация о продукте: адриамцицин (доксорубцин HCl) для инъекций, USP. In (стр. 8)» (PDF). Огайо: Бедфордские лаборатории. 2012 г.
- ^ Такар О., Шриаморнзак П., Дасс ЧР (февраль 2013 г.). «Доксорубицин: обновленная информация о противораковом молекулярном действии, токсичности и новых системах доставки лекарств». Журнал фармации и фармакологии. 65 (2): 157–70. Дои:10.1111 / j.2042-7158.2012.01567.x. PMID 23278683.
- ^ Лю Ю.Л., Керриган Д.Е., Линь С.П., Азарова А.М., Цай Ю.С., Бан Й., Лю Л.Ф. (сентябрь 2007 г.). «Топоизомераза IIbeta опосредованные двухцепочечные разрывы ДНК: влияние на кардиотоксичность доксорубицина и профилактика дексразоксаном». Исследования рака. 67 (18): 8839–46. Дои:10.1158 / 0008-5472.CAN-07-1649. PMID 17875725.
- ^ Эвер М.С., Эвер С.М. (сентябрь 2010 г.). «Тропонин I дает представление о кардиотоксичности и взаимодействии антрациклина и трастузумаба». Журнал клинической онкологии. 28 (25): 3901–4. Дои:10.1200 / JCO.2010.30.6274. PMID 20679626.
- ^ Райсон Д., Ришель Д., Чиа С., Джекиш К., ван дер Вегт С., Сутер Т. (сентябрь 2008 г.). «Схемы антрациклин-трастузумаб при раке молочной железы с гиперэкспрессией HER2 / neu: текущий опыт и будущие стратегии». Анналы онкологии. 19 (9): 1530–9. Дои:10.1093 / annonc / mdn292. PMID 18480068.
- ^ Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, Fleming T., Eiermann W., Wolter J, Pegram M, Baselga J, Norton L (март 2001 г.). «Использование химиотерапии плюс моноклональные антитела против HER2 при метастатическом раке груди, который сверхэкспрессирует HER2». Медицинский журнал Новой Англии. 344 (11): 783–92. Дои:10.1056 / NEJM200103153441101. PMID 11248153.
- ^ Джанни Л., Вигано Л., Локателли А., Капри Дж., Джани А., Тарензи Е., Бонадонна Дж. (Май 1997 г.). «Фармакокинетическая характеристика человека и исследование взаимодействия доксорубицина и паклитаксела in vitro у пациентов с раком груди». Журнал клинической онкологии. 15 (5): 1906–15. Дои:10.1200 / JCO.1997.15.5.1906. PMID 9164201.
Примечания
внешняя ссылка
 СМИ, связанные с Антрациклины в Wikimedia Commons
СМИ, связанные с Антрациклины в Wikimedia Commons

