Развитие нервной системы у человека - Development of the nervous system in humans
| Эта статья является частью серии статей о |
| Развитие системы органов |
|---|
| Нервная система |
| Пищеварительная система |
| Репродуктивная система |
| Мочеиспускательная система |
| Эндокринная система |
| Человеческое развитие |
| Сердечно-сосудистая система |
В развитие нервной системы у человека, или же нейронное развитие или же развитие нервной системы включает изучение эмбриология, биология развития, и нейробиология описать клеточные и молекулярные механизмы, с помощью которых комплекс нервная система формы у человека, развивается во время пренатальное развитие, и продолжает развиваться постнатально.
Некоторые вехи нейронного развития в эмбрион включать рождение и дифференциация из нейроны из стволовая клетка прекурсоры (нейрогенез ); то миграция незрелых нейронов от мест их рождения в эмбрионе до их конечных положений; результат аксоны от нейронов и руководство подвижного конус роста через эмбрион к постсинаптическим партнерам, поколение синапсы между этими аксонами и их постсинаптическими партнерами синаптическая обрезка что происходит в юность и, наконец, пожизненное изменения в синапсах которые, как считается, лежат в основе обучения и памяти.
Обычно эти процессы развития нервной системы можно условно разделить на два класса: механизмы, не зависящие от активности, и механизмы, зависящие от активности. Обычно считается, что независимые от активности механизмы происходят как зашитые процессы, определяемые генетическими программами, исполняемыми в отдельных нейронах. К ним относятся дифференциация, миграция и управление аксоном к их первоначальным целевым областям. Эти процессы считаются независимыми от нейронной активности и сенсорного опыта. Один раз аксоны достигают своих целевых областей, задействуются механизмы, зависящие от деятельности. Нейронная активность и сенсорный опыт будут опосредовать формирование новых синапсы, а также синаптическая пластичность, который будет отвечать за уточнение зарождающихся нейронных цепей.[нужна цитата ]
Развитие человеческого мозга
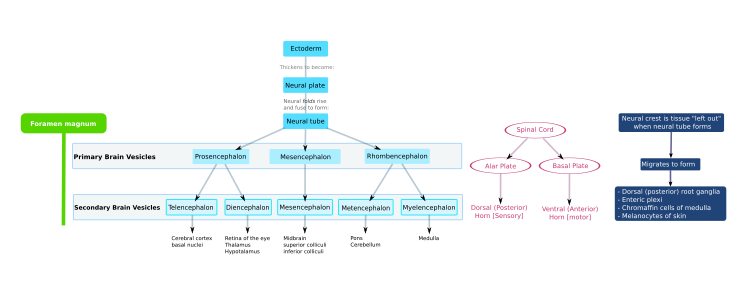
Обзор
В Центральная нервная система (CNS) происходит от эктодерма - самый внешний слой ткани эмбриона. На третьей неделе эмбриональное развитие человека то нейроэктодерма появляется и формирует нервная пластинка по спинной стороне эмбриона. Нервная пластинка является источником большинства нейронов и глиальных клеток ЦНС. Вдоль длинной оси нервной пластинки формируется бороздка, и к четвертой неделе развития нервная пластинка оборачивается сама по себе, давая начало нервная трубка, который заполнен спинномозговая жидкость (CSF).[1] По мере развития эмбриона передняя часть нервной трубки образует три первичные мозговые пузырьки, которые становятся основными анатомическими областями мозга: передний мозг (передний мозг ), средний мозг (средний мозг ), и задний мозг (ромбовидный мозг ). Эти простые ранние пузырьки увеличиваются в размерах и делятся на пять частей. вторичные мозговые пузырьки - в конечный мозг (будущее кора головного мозга и базальный ганглий ), промежуточный мозг (будущее таламус и гипоталамус ), средний мозг (будущее колликулы ), мозговой мозг (будущее мосты и мозжечок ), и продолговатый мозг (будущее мозговое вещество ).[2] Центральная камера, заполненная спинномозговой жидкостью, проходит от конечного мозга к спинному мозгу и составляет развивающийся желудочковая система ЦНС. Поскольку нервная трубка дает начало головному и спинному мозгу, любые мутации на этом этапе развития могут привести к фатальным деформациям, таким как анэнцефалия или пожизненная инвалидность, например расщелина позвоночника. За это время стенки нервной трубки содержат нервные стволовые клетки, которые стимулируют рост мозга при многократном делении. Постепенно некоторые клетки перестают делиться и дифференцируются на нейроны и глиальные клетки, которые являются основными клеточными компонентами ЦНС. Вновь сгенерированные нейроны мигрировать в разные части развивающегося мозга, чтобы самоорганизоваться в разные мозговые структуры. Как только нейроны достигают своих региональных позиций, они расширяются. аксоны и дендриты, которые позволяют им общаться с другими нейронами через синапсы. Синаптическая связь между нейронами приводит к установлению функциональной нейронные цепи которые опосредуют сенсорную и моторную обработку и лежат в основе поведения.[3]
Нейронная индукция
В начале эмбриональное развитие эктодерма становится специфицированной, чтобы дать начало эпидермису (коже) и нервной пластинке. Превращение недифференцированной эктодермы в нейроэктодерму требует сигналов от мезодерма. В начале гаструляции презумптивные мезодермальные клетки проходят через дорсальную губу бластопора и образуют слой между ними. энтодерма и эктодерма. Эти мезодермальные клетки, которые мигрируют по спинной средней линии, образуют структуру, называемую нотохорда. Эктодермальные клетки, покрывающие хорду, развиваются в нервную пластинку в ответ на диффузный сигнал, производимый хордой. Остальная часть эктодермы дает начало эпидермису (коже). Способность мезодермы преобразовывать вышележащую эктодерму в нервную ткань называется нервной индукцией.
В нервная пластинка складывается наружу в течение третьей недели беременности, чтобы сформировать нервная борозда. Начиная с области будущей шеи, нервные складки этой канавки близко, чтобы создать нервная трубка. Образование нервной трубки из эктодермы называется нейруляция. Брюшная часть нервной трубки называется базальная пластинка; спинная часть называется сигнальная пластина. Полый интерьер называется нервный канал. К концу четвертой недели беременности открытые концы нервной трубки, называемые нейропорами, закрываются.[4]
Пересаженная губа бластопора может преобразовывать эктодерму в нервную ткань и, как говорят, обладает индуктивным эффектом. Нервные индукторы - это молекулы, которые могут индуцировать экспрессию нервных генов в эксплантатах эктодермы, не индуцируя также мезодермальные гены. Нейронную индукцию часто изучают в ксеноп эмбрионы, поскольку они имеют простой рисунок тела и есть хорошие маркеры, позволяющие отличить нервную ткань от не нервной. Примерами нейронных индукторов являются молекулы голова и хордин.
Когда эмбриональные эктодермальные клетки культивируются при низкой плотности в отсутствие мезодермальных клеток, они претерпевают нейральную дифференцировку (экспрессируют нейральные гены), предполагая, что нейральная дифференцировка является судьбой эктодермальных клеток по умолчанию. В культурах эксплантатов (которые допускают прямые межклеточные взаимодействия) одни и те же клетки дифференцируются в эпидермис. Это связано с действием BMP4 (а TGF-β семейный белок), который индуцирует дифференцировку эктодермальных культур в эпидермис. Во время нервной индукции ноггин и хордин продуцируются дорсальной мезодермой (хордой) и диффундируют в вышележащую эктодерму, подавляя активность BMP4. Это ингибирование BMP4 заставляет клетки дифференцироваться в нервные клетки. Ингибирование передачи сигналов TGF-β и BMP (костный морфогенетический белок) может эффективно индуцировать нервную ткань человека. плюрипотентные стволовые клетки,[5] модель раннего человеческого развития.
Ранний мозг
В конце четвертой недели верхняя часть нервной трубки сгибает на уровне будущего среднего мозга - средний мозг. Выше средний мозг это передний мозг (будущий передний мозг), а под ним - ромбовидный мозг (будущий задний мозг). В оптический пузырь (который в конечном итоге станет зрительным нервом, сетчаткой и радужной оболочкой) формируется на базальной пластинке переднего мозга.
Спинной мозг формируется из нижней части нервной трубки. Стенка нервной трубки состоит из нейроэпителиальных клеток, которые дифференцируются в нейробласты, формируя мантийный слой (серое вещество). Из этих нейробластов выходят нервные волокна, формирующие маргинальный слой (белое вещество). Вентральная часть мантийного слоя (базальные пластинки) образует двигательные области спинного мозга, а дорсальная часть (крыловидные пластинки) - сенсорные области. Между базальной и крыловой пластинами находится промежуточный слой, содержащий нейроны вегетативной нервной системы.[6]
На пятой неделе крылатая пластинка переднего мозга расширяется, образуя полушария головного мозга ( конечный мозг ). Базальная пластинка становится промежуточный мозг.
Промежуточный мозг, средний мозг и ромбовидный мозг составляют мозговой ствол эмбриона. Он продолжает изгибаться в среднем мозге. Ромбовидный мозг изгибается кзади, в результате чего его крыловидная пластинка расширяется и образует четвертый желудочек мозга. В мосты и мозжечок формируются в верхней части ромбовидного мозга, в то время как продолговатый мозг формируется в нижней части.
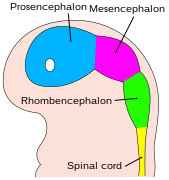
Мозг эмбриона в четыре недели.

Поперечный разрез развивающегося спинного мозга через четыре недели.
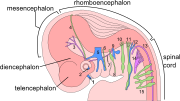
Нервная система эмбриона в шесть недель.
Нейровизуализация
Нейровизуализация отвечает за большие успехи в понимании того, как развивается мозг. ЭЭГ и ERP - эффективные методы визуализации, используемые в основном для младенцев и маленьких детей, поскольку они более щадящие. Младенцы обычно проходят тестирование с fNIRS. В МРТ и фМРТ широко используются для исследования мозга благодаря качеству изображений и возможному их анализу.
Магнитно-резонансная томография
МРТ помогают анализировать многие аспекты мозга. Коэффициент передачи намагниченности (MTR) измеряет целостность с помощью намагничивания. Дробная анизотропия (FA) измеряет организацию, используя диффузию молекул воды. Кроме того, средний коэффициент диффузии (MD) измеряет силу белое вещество трактаты.[7]
Структурная магнитно-резонансная томография
С помощью структурной МРТ может быть проведена количественная оценка ряда процессов развития, включая определение моделей роста,[8] и характеризуя последовательность миелинизации.[9] Эти данные дополняют свидетельства Диффузионная тензорная визуализация (DTI) исследования, которые широко использовались для изучения развития белого вещества.
Функциональная магнитно-резонансная томография
Ментализация теста фМРТ, которая представляет собой теорию разума путем активации сети. Задняя верхняя височная борозда (pSTS) и височно-теменное соединение (TPJ) помогают прогнозировать движение. У взрослых правильный pSTS показал больший ответ, чем тот же регион у подростков, при тестировании на преднамеренную причинность. Эти области также были активированы во время упражнения «разум в глазах», когда эмоции должны оцениваться на основе различных изображений глаз. Другой ключевой регион - это передняя височная кора (ATC) в задней части. У взрослых левая АТС показала больший ответ, чем та же область у подростков, при тестировании эмоциональных тестов на ментализацию. Наконец, медиальная префронтальная кора (MPFC) и передний дорсальный MPFC (dMPFC) активируются, когда разум стимулируется психологией.[7]
Трехмерная сонография
Изображение с более высоким разрешением позволило трехмерное ультразвуковое исследование чтобы помочь определить развитие человеческого мозга на эмбриональных стадиях. Исследования показывают, что в шестой гестационный неделю. Эти передний мозг, то средний мозг, а задний мозг, также известный как передний мозг, средний мозг и ромбовидный мозг соответственно. Пять вторичных структур из них на седьмой неделе беременности. Это конечный мозг, промежуточный мозг, средний мозг, средний мозг и продолговатый мозг, которые позже становятся боковыми желудочками, третьими желудочками, водопроводом, а также верхними и нижними частями четвертого желудочка от конечного мозга до продолговатого мозга в зрелом возрасте. Трехмерная ультразвуковая визуализация позволяет in vivo изобразить идеальное развитие мозга, что может помочь распознать отклонения во время беременности.[10]
Развитие белого вещества
Исследования показали, что с помощью МРТ белое вещество увеличивается с детства (~ 9 лет) до подросткового возраста (~ 14 лет), серое вещество уменьшается. Это наблюдалось в первую очередь в лобной и теменной коре. Теории относительно того, почему это происходит, разнятся. Считается, что внутрикортикальная миелинизация в сочетании с увеличением размера аксонов увеличивает объем ткани белого вещества. Другой заключается в том, что синаптическая реорганизация происходит в результате пролиферации, а затем сокращения.[7]
Развитие серого вещества
Рост и падение объема серое вещество в лобных и теменных долях достигает пика примерно в 12 лет. Пик для височных долей составил ~ 17 лет, причем верхняя височная кора созревала последней. Сначала созревают сенсорные и моторные области, после чего развивается остальная часть коры. Это характеризовалось потерей серого вещества и происходило от задней части к передней. Эта потеря серого вещества и увеличение белого вещества может происходить в течение всей жизни, хотя более сильные изменения происходят с детства до подросткового возраста.[7]
Нейрональная миграция
Миграция нейронов - это метод, с помощью которого нейроны перемещаются из места своего происхождения или места рождения в свое конечное положение в мозге. Их наиболее распространенные средства миграция бывают радиальная и тангенциальная миграция.
Радиальная миграция
Нервные стволовые клетки пролиферируют в желудочковой зоне развивающихся неокортекс. Первый постмитотический клетки мигрировать из препланта, которым суждено стать Клетки Кахаля-Ретциуса и плита нейроны. Эти клетки делают это посредством сомальной транслокации. Нейроны, мигрирующие с этим способом передвижения, биполярны и прикрепляют передний край процесса к пиа. В сома затем переносится на поверхность пиальной оболочки посредством нуклеокениза, процесса, посредством которого микротрубочка «клетка» вокруг ядра удлиняется и сжимается вместе с центросома чтобы направить ядро к его конечному пункту назначения.[11] Радиальные волокна (также известные как радиальная глия) могут перемещаться в кортикальную пластинку и дифференцироваться в астроциты или же нейроны.[12][нужна цитата ] Сомальная транслокация может произойти в любой момент развития.[13]
Последующие волны нейронов расщепляют предварительную пластину, перемещаясь по ней. лучевая глия волокна для формирования корковой пластинки. Каждая волна мигрирующих клеток проходит мимо своих предшественников, образуя слои наизнанку, а это означает, что самые молодые нейроны находятся ближе всего к поверхности.[14][15] Подсчитано, что миграция под глиальным контролем составляет 80-90% мигрирующих нейронов.[16]
Аксофильная миграция
Многие нейроны, мигрирующие вдоль передне-задней оси тела, используют существующие тракты аксонов для миграции в процессе, называемом аксофильной миграцией.[17] Пример этого режима миграции приведен в ГнРГ-экспрессирующие нейроны, которые совершают долгий путь от места своего рождения по носу, через передний мозг и в гипоталамус.[18] Многие механизмы этой миграции были разработаны, начиная с внеклеточных ориентиров.[19] которые запускают внутриклеточную передачу сигналов. Эти внутриклеточные сигналы, такие как кальциевая сигнализация, привести к актин [20] и микротрубочка [21] цитоскелетная динамика, которая производит клеточные силы, которые взаимодействуют с внеклеточной средой через белки клеточной адгезии [22] вызвать движение этих клеток. Нейрофильная миграция относится к миграции нейронов вдоль аксона, принадлежащего другому нерву. Глиофильная миграция миграция глия вдоль глиальных волокон.[23]
Тангенциальная миграция
Большинство интернейронов перемещаются по касательной через несколько способов миграции, чтобы достичь своего соответствующего местоположения в коре головного мозга. Примером тангенциальной миграции является перемещение Клетки Кахаля-Ретциуса в пределах маргинальной зоны коркового нейроэпителия.[24]
Другие
Существует также метод миграции нейронов, называемый многополярная миграция.[25][26] Это наблюдается в мультиполярных клетках, которые в большом количестве присутствуют в корковая промежуточная зона. Они не похожи на клетки, мигрирующие посредством локомоции или сомальной транслокации. Вместо этого эти мультиполярные клетки экспрессируют нейрональные маркеры и распространяют множество тонких отростков в различных направлениях независимо от радиальных глиальных волокон.[25]
Нейротрофические факторы
Нейротрофические факторы представляют собой молекулы, которые способствуют и регулируют выживание нейронов в развивающейся нервной системе. Их отличают от повсеместных метаболиты необходимы для поддержания и роста клеток в силу их специфичности; каждый нейротрофический фактор способствует выживанию только определенных типов нейронов на определенной стадии их развития. Кроме того, утверждалось, что нейротрофические факторы участвуют во многих других аспектах развития нейронов, начиная от управления аксонами и заканчивая регуляцией синтеза нейротрансмиттеров.[27]
Развитие нервной системы у взрослых
Нейроразвитие взрослой нервной системы включает такие механизмы, как: ремиелинизация, генерация новых нейронов, глия, аксоны, миелин или же синапсы. Нейрорегенерация различается между периферическая нервная система (PNS) и Центральная нервная система (ЦНС) функциональными механизмами и особенно степенью и скоростью.
Исследование
Пространственно-временное моделирование развития мозга
На раннем этапе развития (до рождения и в течение первых нескольких месяцев) мозг претерпевает больше изменений в размере, форме и структуре, чем в любой другой период жизни. Лучшее понимание мозгового развития в этот критический период важно для картирования нормального роста и для исследования механизмов травм, связанных с факторами риска неправильного развития, такими как преждевременные роды. Следовательно, существует потребность в плотном охвате этого возрастного диапазона изменяющимся во времени и зависящим от возраста атласом. Такие пространственно-временные атласы могут точно отображать динамические изменения, происходящие на раннем этапе развития мозга.[8] и может использоваться как нормативное справочное пространство.
Кроме того, были проведены крупномасштабные исследования экспрессии генов в различных областях мозга от ранней беременности до старения. Такие данные дают уникальное представление об изменениях, которые происходят в мозге за этот длительный период. Этот подход показал, что экспрессируются 86 процентов генов и что 90 процентов из них дифференцированно регулируются на уровне полного транскрипта или экзона в разных областях мозга и / или во времени. Большинство этих пространственно-временных различий было обнаружено еще до рождения, с последующим увеличением сходства между региональными транскриптомами. Кроме того, межреальные различия демонстрируют временную модель песочных часов, разделяющую развитие неокортекса человека на три основные фазы. Во время первой фазы, в первые шесть месяцев после зачатия, общая архитектура областей мозга в значительной степени формируется всплеском генетической активности, которая характерна для конкретных областей неокортекса. За этим порывом следует своего рода перерыв, начинающийся в третьем триместре беременности. В этот период подавляется большинство генов, активных в определенных областях мозга, за исключением генов, которые стимулируют связи между всеми областями неокортекса. Затем, в позднем детстве и раннем подростковом возрасте, генетический оркестр начинается снова и помогает тонко формировать области неокортекса, которые постепенно выполняют более специализированные задачи, процесс, который продолжается во взрослой жизни.[28][29][30]
Конкретные регионы
Благодаря доступной неинвазивной визуализации исследователи смогли сделать новые открытия для различных частей мозга.
- Медиальная префронтальная кора (MPFC)
В этом регионе у подростков отмечается больше активности, чем у взрослых, когда они сталкиваются с тестами на задачи ментализации, а также на коммуникативные и личные намерения. Снижение активности от подросткового до взрослого возраста. В задаче ментализации с использованием анимации dMPFC больше стимулировался у взрослых, в то время как вентральный MPFC стимулировался больше у детей. Их можно отнести к использованию объективной стратегии, связанной с dMPFC. Теории снижения активности от подросткового до взрослого возраста различаются. Одна теория состоит в том, что когнитивная стратегия становится более автоматической с возрастом, а другая - в том, что функциональные изменения происходят параллельно с нейроанатомическими изменениями, которые характеризуются синаптогенезом и сокращением.[7]
MPFC - это пример одной конкретной области, которая стала лучше понятна с помощью современных методов визуализации. Текущие исследования предоставляют гораздо больше подобных выводов.
Стресс в молодости
Стресс в раннем возрасте определяется как воздействие обстоятельств в детстве, которые перегружают возможности ребенка справляться с трудностями и приводят к длительным периодам стресса.[31] Результаты многочисленных исследований показывают, что влияние стресса в раннем возрасте на развивающийся мозг является значительным и включает, помимо прочего, следующее: увеличение объема миндалины,[32][33] снижение активности лобных корковых и лимбических структур головного мозга,[34] и измененные структуры белого вещества.[35]
Считается, что стресс в раннем возрасте вызывает изменения в развитии мозга, препятствуя нейрогенезу, синаптическому производству и сокращению синапсов и рецепторов.[31] Взаимодействие с этими процессами может привести к увеличению или уменьшению объемов областей мозга, что потенциально объясняет выводы о том, что стресс в раннем возрасте связан с увеличением объема миндалины и уменьшением объема коры передней поясной извилины.[32][36]
Из литературы было сделано несколько важных выводов. Области мозга, которые претерпевают значительное послеродовое развитие, например, те, которые связаны с памятью и эмоциями, более уязвимы к воздействию стресса в раннем возрасте.[31][37] Например, гиппокамп продолжает развиваться после рождения и является структурой, на которую влияет жестокое обращение в детстве.[37] Стресс в раннем детстве, по-видимому, мешает перепроизводству синапсов, что типично для детства, но не мешает сокращению синапсов в подростковом возрасте. Это приводит к уменьшению объема гиппокампа, что потенциально объясняет связь между стрессом в раннем возрасте и уменьшением объема гиппокампа.[36] Это уменьшение объема может быть связано с дефицитом регуляции эмоций, наблюдаемым у людей, подвергшихся стрессу в раннем возрасте.
Миндалевидное тело особенно уязвимо для стресса в раннем детстве.[31] Миндалевидное тело также претерпевает значительное развитие в детстве, структурно и функционально изменяется у людей, переживших стресс в раннем возрасте, и связано с социально-эмоциональными трудностями, связанными со стрессом в раннем возрасте.
Тип рецептора - еще один фактор, который необходимо учитывать при определении того, чувствительна ли область мозга к воздействию стресса в раннем детстве. Области мозга с высокой плотностью глюкокортикоидных рецепторов особенно уязвимы к воздействию стресса в раннем возрасте, вероятно, потому, что глюкокортикоиды связываются с этими рецепторами во время стрессового воздействия, способствуя развитию реакций выживания за счет других важных нервных путей.[37] Некоторыми примерами областей мозга с высокой плотностью рецепторов глюкокортикоидов являются гиппокамп и червь мозжечка. Стресс активирует ось HPA и приводит к выработке глюкокортикоидов. Повышенная выработка глюкокортикоидов приводит к повышенной активации этих областей мозга, способствуя развитию одних нервных путей за счет других.
Нарушения в структуре и функции мозга часто связаны с дефицитом, который может сохраняться в течение многих лет после снятия стресса и может быть фактором риска будущей психопатологии.[31] Области мозга, наиболее чувствительные к стрессу в раннем возрасте, - это те, которые претерпевают изменения в развитии во время воздействия стресса. В результате стресс изменяет траекторию развития этой области мозга, вызывая долгосрочные изменения в структуре и функциях.
Распространенные типы стресса в раннем детстве, которые задокументированы, включают плохое обращение, пренебрежение и предыдущее помещение в лечебные учреждения. Было также показано, что жизнь в бедности аналогичным образом влияет на работу мозга.[38]
Смотрите также
- Хронология развития человеческого мозга
- KCC2
- Расстройства нервного развития
- Нейронный дарвинизм
- Пре- и перинатальная психология
внешняя ссылка
- Промежуток времени последовательности радиальной миграции (также известной как глиальное руководство) и сомальной транслокации.[13]
Рекомендации
- ^ Саладин, К. (2011). Анатомия и физиология: единство формы и функции (6-е изд.). Макгроу-Хилл. п. 541. ISBN 9780073378251.
- ^ Гилберт, Скотт (2013). Биология развития (Десятое изд.). Sinauer Associates Inc. ISBN 978-1605351926.
- ^ Кандел, Эрик Р. (2006). Принципы нейронауки (5. изд.). Эпплтон и Ланге: Макгроу Хилл. ISBN 978-0071390118.
- ^ Estomih Mtui; Грегори Грюнер (2006). Клиническая нейроанатомия и неврология. Филадельфия: Сондерс. п. 1. ISBN 978-1-4160-3445-2.
- ^ Чемберс, С. М .; и другие. (2009). «Высокоэффективное нейронное преобразование человеческих ES- и iPS-клеток путем двойного ингибирования передачи сигналов SMAD». Природа Биотехнологии. 27 (3): 275–280. Дои:10.1038 / nbt.1529. ЧВК 2756723. PMID 19252484.
- ^ Атлас эмбриологии человека, Chronolab В архиве 2007-12-27 на Wayback Machine. Последний доступ 30 октября 2007 г.
- ^ а б c d е Блейкмор, С. Дж. (Июнь 2012 г.). «Визуализация развития мозга: мозг подростка». NeuroImage. 61 (2): 397–406. Дои:10.1016 / j.neuroimage.2011.11.080. PMID 22178817.
- ^ а б Serag, A .; и другие. (2012). «Построение последовательного пространственно-временного атласа высокого разрешения развивающегося мозга с использованием адаптивной ядерной регрессии». NeuroImage. 59 (3): 2255–2265. Дои:10.1016 / j.neuroimage.2011.09.062. PMID 21985910.
- ^ Сераг, Ахмед; и другие. (2011). «Отслеживание изменений в развитии подкорковых структур головного мозга недоношенных с помощью мультимодальной МРТ». 2011 Международный симпозиум IEEE по биомедицинской визуализации: от нано к макро. С. 349–352. Дои:10.1109 / ISBI.2011.5872421. ISBN 978-1-4244-4127-3.
- ^ Kim, M. S .; и другие. (Январь 2008 г.). «Трехмерные сонографические оценки эмбрионального развития мозга». Журнал ультразвука в медицине. 27 (1): 119–124. Дои:10.7863 / jum.2008.27.1.119. PMID 18096737.
- ^ Самуэльс Б.А., Цай Л.Х. (ноябрь 2004 г.). «Нуклеокинез освещенный». Природа Неврология. 7 (11): 1169–70. Дои:10.1038 / нн1104-1169. PMID 15508010.
- ^ Кэмпбелл К., Гётц М. (май 2002 г.). «Радиальная глия: многоцелевые клетки для развития мозга позвоночных». Тенденции в неврологии. 25 (5): 235–8. Дои:10.1016 / S0166-2236 (02) 02156-2. PMID 11972958.
- ^ а б Надараджа Б., Брунстрем Дж., Груцендлер Дж., Вонг РО, Перлман А.Л. (февраль 2001 г.). «Два режима радиальной миграции в раннем развитии коры головного мозга». Природа Неврология. 4 (2): 143–50. Дои:10.1038/83967. PMID 11175874.
- ^ Надараджа Б., Парнавелас Дж. Г. (июнь 2002 г.). «Способы миграции нейронов в развивающейся коре головного мозга». Обзоры природы. Неврология. 3 (6): 423–32. Дои:10.1038 / nrn845. PMID 12042877.
- ^ Ракич П. (май 1972 г.). «Способ миграции клеток к поверхностным слоям неокортекса эмбриона обезьяны». Журнал сравнительной неврологии. 145 (1): 61–83. Дои:10.1002 / cne.901450105. PMID 4624784.
- ^ Хаттен, Мэри (1999). Миграция нейронов центральной нервной системы (PDF). Ежегодные обзоры в области неврологии.
- ^ Casoni, F; Хатчинс, Б.И.; Донохью, Д; Форнаро, М; Condie, BG; Рэй, С. (1 ноября 2012 г.). «SDF и GABA взаимодействуют, чтобы регулировать аксофильную миграцию нейронов GnRH». Журнал клеточной науки. 125 (Pt 21): 5015–25. Дои:10.1242 / jcs.101675. ЧВК 3533389. PMID 22976302.
- ^ Wray S (июль 2010 г.). «Из носа в мозг: развитие нейронов гонадотропин-рилизинг-гормона-1». Журнал нейроэндокринологии. 22 (7): 743–53. Дои:10.1111 / j.1365-2826.2010.02034.x. ЧВК 2919238. PMID 20646175.
- ^ Джакобини П., Мессина А., Рэй С., Джампьетро С., Крепальди Т., Кармелье П., Фасоло А. (январь 2007 г.). «Фактор роста гепатоцитов действует как мотор и направляющий сигнал для миграции нейронов гонадотропинового гормона-рилизинг-гормона-1». Журнал неврологии. 27 (2): 431–45. Дои:10.1523 / JNEUROSCI.4979-06.2007. ЧВК 6672060. PMID 17215404.
- ^ Хатчинс Б.И., Кленке Ю., Рэй С. (июль 2013 г.). «Зависимый от высвобождения кальция поток актина в ведущем процессе опосредует миграцию аксофилов». Журнал неврологии. 33 (28): 11361–71. Дои:10.1523 / JNEUROSCI.3758-12.2013. ЧВК 3724331. PMID 23843509.
- ^ Хатчинс Б.И., Рэй С. (2014). «Захват плюсовых концов микротрубочек актиновой корой способствует миграции аксофильных нейронов за счет увеличения натяжения микротрубочек в ведущем процессе». Границы клеточной неврологии. 8: 400. Дои:10.3389 / fncel.2014.00400. ЧВК 4245908. PMID 25505874.
- ^ Parkash J, Cimino I, Ferraris N, Casoni F, Wray S, Cappy H, Prevot V, Giacobini P (ноябрь 2012 г.). «Подавление β1-интегрина в клетках гонадотропин-рилизинг-гормона нарушает миграцию и удлинение аксонов, что приводит к серьезным репродуктивным изменениям». Журнал неврологии. 32 (47): 16992–7002. Дои:10.1523 / JNEUROSCI.3057-12.2012. ЧВК 5238668. PMID 23175850.
- ^ Купер, Джонатан А. (2 сентября 2013 г.). «Механизмы миграции клеток в нервной системеМеханизмы миграции клеток в нервной системе». Журнал клеточной биологии. 202 (5): 725–734. Дои:10.1083 / jcb.201305021. ЧВК 3760606. PMID 23999166.
- ^ Чен Дж. П., Чжан Д. В., Лю Дж. М. (июль 2016 г.). «Экзотические кристаллы скирмионов в хиральных магнитах с анизотропией компаса». Научные отчеты. 6: 29126. Bibcode:2016НатСР ... 629126С. Дои:10.1038 / srep29126. ЧВК 4932608. PMID 27377149.
- ^ а б Табата Х., Накадзима К. (ноябрь 2003 г.). «Мультиполярная миграция: третий способ миграции радиальных нейронов в развивающейся коре головного мозга». Журнал неврологии. 23 (31): 9996–10001. Дои:10.1523 / JNEUROSCI.23-31-09996.2003. ЧВК 6740853. PMID 14602813.
- ^ Надараджа Б., Алифрагис П., Вонг РО, Парнавелас Дж. Г. (июнь 2003 г.). «Миграция нейронов в развивающейся коре головного мозга: наблюдения на основе изображений в реальном времени». Кора головного мозга. 13 (6): 607–11. Дои:10.1093 / cercor / 13.6.607. PMID 12764035.
- ^ Алан М. Дэвис (1 мая 1988 г.) «Тенденции в генетике», том 4, выпуск 5; Отделение анатомии, Медицинская школа больницы Святого Георгия, Кранмер Террас, Тутинг, Лондон, SW17 0RE, Великобритания
- ^ Плетикос, М; и другие. (22 января 2014 г.). «Временная спецификация и билатеральность экспрессии топографических генов неокортекса человека». Нейрон. 81 (2): 321–32. Дои:10.1016 / j.neuron.2013.11.018. ЧВК 3931000. PMID 24373884.
- ^ Кан, Хё Чжон; и другие. (27 октября 2011 г.). «Пространственно-временной транскриптом человеческого мозга». Природа. 478 (7370): 483–489. Bibcode:2011Натура.478..483K. Дои:10.1038 / природа10523. ЧВК 3566780. PMID 22031440.
- ^ «Развитие человеческого мозга - это симфония в трех частях». Йельские новости. 2013-12-26. Получено 26 декабря, 2013.
- ^ а б c d е Печтель, Пиа; Пиццагалли, Диего А. (2010). «Влияние стресса в раннем детстве на когнитивные и аффективные функции: интегрированный обзор литературы». Психофармакология. 214 (1): 55–70. Дои:10.1007 / s00213-010-2009-2. ЧВК 3050094. PMID 20865251.
- ^ а б Mehta, Mitul A .; Голембо, Николь I .; Носарти, Кьяра; Колверт, Эмма; Мота, Эшли; Уильямс, Стивен С. Р .; Раттер, Майкл; Сонуга-Барке, Эдмунд Дж. С. (2009). «Размер миндалевидного тела, гиппокампа и мозолистого тела после тяжелой ранней институциональной депривации: пилотное исследование для усыновленных из Англии и Румынии». Журнал детской психологии и психиатрии. 50 (8): 943–51. Дои:10.1111 / j.1469-7610.2009.02084.x. PMID 19457047.
- ^ Тоттенхэм, Ним; Hare, Todd A .; Куинн, Брайан Т .; Маккарри, Томас У .; Медсестра, Марселла; Гилхули, Тара; Милльнер, Александр; Гальван, Адриана; Дэвидсон, Мэтью С .; Эйгсти, Инге-Мари; Томас, Кэтлин М .; Фрид, Питер Дж .; Booma, Elizabeth S .; Gunnar, Megan R .; Альтемус, Маргарет; Аронсон, Джейн; Кейси, Б.Дж. (2010). «Длительное институциональное воспитание связано с атипично большим объемом миндалины и трудностями в регуляции эмоций». Наука о развитии. 13 (1): 46–61. Дои:10.1111 / j.1467-7687.2009.00852.x. ЧВК 2817950. PMID 20121862.
- ^ Чугани, Гарри Т .; Бехен, Майкл Э .; Музик, Отто; Юхас, Чаба; Надь, Ференц; Чугани, Дайан С. (2001). «Функциональная активность местного мозга после ранней депривации: исследование румынских сирот в постинституциональном периоде». NeuroImage. 14 (6): 1290–301. Дои:10.1006 / nimg.2001.0917. PMID 11707085.
- ^ Eluvathingal, T. J .; Chugani, H.T .; Behen, M.E .; Юхас, К. Музик, О; Maqbool, M; Chugani, D.C .; Макки, М. (2006). «Аномальная связь мозга у детей после ранней тяжелой социально-эмоциональной депривации: исследование диффузного тензорного изображения». Педиатрия. 117 (6): 2093–100. Дои:10.1542 / пед.2005-1727. PMID 16740852.
- ^ а б Бейкер, Лори М .; Уильямс, Линн М .; Коргаонкар, Маюреш С .; Коэн, Рональд А .; Куча, Джоди М .; Пол, Роберт Х. (2012). «Влияние стресса раннего и позднего детства на морфометрию мозга». Визуализация мозга и поведение. 7 (2): 196–203. Дои:10.1007 / s11682-012-9215-у. PMID 23247614.
- ^ а б c Teicher, Martin H .; Андерсен, Сьюзен Л .; Полкари, Энн; Андерсон, Карл М .; Navalta, Carryl P .; Ким, Деннис М. (2003). «Нейробиологические последствия раннего стресса и жестокого обращения в детстве». Неврология и биоповеденческие обзоры. 27 (1–2): 33–44. Дои:10.1016 / S0149-7634 (03) 00007-1. PMID 12732221.
- ^ Kim, P .; Evans, G.W .; Ангштадт, М .; Ho, S. S .; Sripada, C.S .; Swain, J. E .; Liberzon, I .; Фан, К. Л. (2013). «Влияние детской бедности и хронического стресса на функцию мозга, регулирующую эмоции, в зрелом возрасте». Труды Национальной академии наук. 110 (46): 18442–7. Bibcode:2013ПНАС..11018442K. Дои:10.1073 / pnas.1308240110. ЧВК 3831978. PMID 24145409.



