Фотоэлектрохимическая ячейка - Photoelectrochemical cell
А "фотоэлектрохимическая ячейка"- это один из двух различных классов устройств. Первый производит электрическую энергию аналогично сенсибилизированный красителем фотоэлектрический элемент, что соответствует стандартному определению фотоэлектрический элемент. Второй - это фотоэлектролитическая ячейка, то есть устройство, использующее свет, падающий на фотосенсибилизатор, полупроводник, или водный металл погружают в раствор электролита, чтобы непосредственно вызвать химическую реакцию, например, чтобы произвести водород через электролиз воды.
Оба типа устройств являются разновидностями солнечная батарея, в том, что функция фотоэлектрохимического элемента заключается в использовании фотоэлектрический эффект (или, очень похоже, фотоэлектрический эффект ) преобразовать электромагнитное излучение (обычно солнечный свет) либо непосредственно в электрическую энергию, либо во что-то, что само может быть легко использовано для производства электроэнергии (например, водород можно сжечь, чтобы создавать электрическую энергию, видеть фотоводород ).
Два принципа
Стандарт фотоэлектрический эффект, как в стандартной фотоэлектрические элементы, включает в себя возбуждение отрицательных носителей заряда (электронов) в полупроводниковой среде, и именно отрицательные носители заряда (свободные электроны) в конечном итоге извлекаются для выработки энергии. Классификация фотоэлектрохимических ячеек, в которую входят: Клетки Гретцеля соответствует этому узкому определению, хотя носители заряда часто экситонный.
С другой стороны, ситуация в фотоэлектролитической ячейке совершенно иная. Например, в фотоэлектрохимической ячейке, расщепляющей воду, возбуждение светом электрона в полупроводнике оставляет дыру, которая «вытягивает» электрон из соседней молекулы воды:
В результате в растворе остаются носители положительного заряда (протоны, то есть ионы H +), которые затем должны связываться с одним другим протоном и объединяться с двумя электронами, чтобы образовать газообразный водород, согласно:
А фотосинтетическая клетка - это еще одна форма фотоэлектролитической ячейки, на выходе которой вместо молекулярного водорода будут углеводы.
Фотоэлектролитическая ячейка
Фотоэлектролитическая ячейка А (водоразделительная) электролизует вода в водород и кислород газ путем облучения анод с электромагнитное излучение, то есть со светом. Это было названо искусственный фотосинтез и был предложен как способ хранения солнечная энергия в водород для использования в качестве топлива.[1]
Попадающий солнечный свет возбуждает свободные электроны у поверхности кремниевого электрода. Эти электроны проходят через провода к электроду из нержавеющей стали, где четыре из них реагируют с четырьмя молекулами воды с образованием двух молекул водорода и 4 групп ОН. Группы ОН протекают через жидкий электролит к поверхности кремниевого электрода. Там они вступают в реакцию с четырьмя дырками, связанными с четырьмя фотоэлектронами, в результате чего образуются две молекулы воды и молекула кислорода. Освещенный кремний сразу начинает разъедать при контакте с электролитами. Коррозия расходует материал и нарушает свойства поверхностей и границ раздела в ячейке.[2]
Два типа фотохимический системы работают через фотокатализ. В качестве катализаторов используются поверхности полупроводников. В этих устройствах полупроводник поверхность поглощает солнечную энергию и действует как электрод для расщепление воды. В другой методике в качестве катализаторов используются комплексы металлов в растворе.[3][4]
Фотоэлектролитические ячейки прошли 10 процентов экономическая эффективность барьер. Коррозия из полупроводники остается проблемой, учитывая их прямой контакт с водой.[5] В настоящее время продолжаются исследования, чтобы достичь срок службы 10000 часов, требование, установленное Министерство энергетики США.[6]
Другие фотоэлектрохимические ячейки
Первый фотоэлектрический элемент когда-либо созданный, был также первым фотоэлектрохимическим элементом. Он был создан в 1839 г. Александр-Эдмон Беккерель в 19 лет, в лаборатории отца.[7]
Наиболее часто исследуемая современная фотоэлектрохимическая ячейка в последние десятилетия была Ячейка Гретцеля, хотя в последнее время много внимания сместилось с этой темы на перовскитовые солнечные элементы из-за относительно высокой эффективности последних и схожести методов осаждения из паровой фазы, обычно используемых при их создании.
В сенсибилизированных красителем солнечных элементах или элементах Гретцеля используются красители.адсорбированный высокопористый нанокристаллический оксид титана (NC-TiO
2) для производства электроэнергии.
Материалы для фотоэлектролитических ячеек
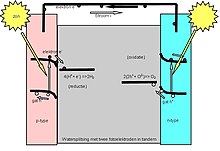
Водоразделительные фотоэлектрохимические (PEC) элементы используют световую энергию для разложения воды на водород и кислород в двухэлектродном элементе. Теоретически существует три варианта расположения фотоэлектродов в сборке PEC:[8]
- фотоанод из полупроводника n-типа и металлического катода
- фотоанод из полупроводника n-типа и фотокатод из полупроводника p-типа
- фотокатод из полупроводника p-типа и металлического анода
К фотоэлектродным материалам в PEC предъявляются несколько требований. производство[9]:
- светопоглощение: определяется шириной запрещенной зоны и соответствует спектру солнечного излучения
- перенос заряда: фотоэлектроды должны быть проводящими (или полупроводящими), чтобы минимизировать резистивные потери
- подходящая зонная структура: достаточно большая запрещенная зона для разделения воды (1,23 В) и соответствующие положения относительно окислительно-восстановительных потенциалов для и
- каталитическая активность: высокая каталитическая активность увеличивает эффективность реакции расщепления воды
- стабильность: материалы должны быть стабильными, чтобы предотвратить разложение и потерю функции
В дополнение к этим требованиям, материалы должны быть недорогими и доступными для земли, чтобы стало возможным широкое внедрение разделения воды с помощью PEC.
Хотя перечисленные требования могут применяться в целом, фотоаноды и фотокатоды имеют несколько разные потребности. У хорошего фотокатода будет раннее начало реакции выделения кислорода (низкое перенапряжение), большой фототок при насыщении и быстрый рост фототока в начале. С другой стороны, хорошие фотоаноды будут иметь раннее начало реакции выделения водорода в дополнение к сильному току и быстрому росту фототока. Чтобы максимизировать ток, материалы анода и катода должны быть согласованы друг с другом; лучший анод для одного материала катода может не подойти для другого.
TiO
2
В 1967 г. Акира Фудзисима обнаружил Эффект Хонда-Фудзисима, (фотокаталитические свойства диоксида титана).
TiO
2 и оксиды других металлов по-прежнему наиболее заметны[10] катализаторы по соображениям эффективности. Включая SrTiO
3 и BaTiO
3,[11] этот вид полупроводников титанаты, то зона проводимости имеет в основном титановый 3D-характер, а валентная полоса кислород 2р характер. Полосы разделены широким запрещенная зона не менее 3 эВ, так что эти материалы поглощают только УФ-излучение. Изменение TiO
2 микроструктура также была исследована для дальнейшего повышения производительности, например TiO
2 массивы нанопроволок или пористые нанокристаллические TiO
2 фотоэлектрохимические ячейки.[12]
GaN
GaN - еще один вариант, потому что нитриды металлов обычно имеют узкую запрещенную зону, которая может охватывать почти весь солнечный спектр.[13] GaN имеет более узкую запрещенную зону, чем TiO
2 но все еще достаточно большой, чтобы позволить воде расщепляться на поверхности. Нанопроволоки GaN показали лучшие характеристики, чем тонкие пленки GaN, потому что они имеют большую площадь поверхности и высокую монокристалличность, что обеспечивает более длительное время жизни электронно-дырочной пары.[14] Между тем, другие неоксидные полупроводники, такие как GaAs, MoS
2, WSe
2 и MoSe
2 используются в качестве электродов n-типа из-за их стабильности в химических и электрохимических стадиях реакций фотокоррозии.[15]
Кремний
В 2013 году ячейка с 2 нанометрами никеля на кремниевом электроде в паре с электродом из нержавеющей стали, погруженная в водный электролит борат калия и борат лития проработал 80 часов без заметной коррозии по сравнению с 8 часами для диоксида титана. В процессе было произведено около 150 мл газообразного водорода, что представляет собой хранилище около 2 килоджоулей энергии.[2][16]
Структурированные материалы
Структурирование поглощающих материалов оказывает как положительное, так и отрицательное влияние на характеристики ячеек. Структурирование позволяет поглощать свет и собирать носители в разных местах, что снижает требования к чистым материалам и способствует катализу. Это позволяет использовать неблагородные и оксидные катализаторы, которые могут быть стабильными в более окислительных условиях. Однако эти устройства имеют более низкие потенциалы холостого хода, что может способствовать снижению производительности.[17]
Гематит

Исследователи тщательно исследовали использование гематита (α-Fe2O3) в устройствах для разделения воды на основе PEC из-за его низкой стоимости, легирования n-типа и ширины запрещенной зоны (2,2 эВ). Однако производительность ухудшается из-за плохой проводимости и анизотропии кристаллов.[18] Некоторые исследователи усилили каталитическую активность за счет образования на поверхности слоя сокатализаторов. Сокатализаторы включают кобальтфосфат.[19] и оксид иридия[20], который, как известно, является высокоактивным катализатором реакции выделения кислорода.[17]
Оксид вольфрама
Оксид вольфрама (VI) (WO3), который имеет несколько различных полиморфов при различных температурах, представляет интерес из-за своей высокой проводимости, но имеет относительно широкую непрямую запрещенную зону (~ 2,7 эВ), что означает, что он не может поглощать большую часть солнечного спектра. . Хотя было предпринято много попыток увеличить поглощение, они привели к плохой проводимости, и, таким образом, WO3, по-видимому, не является жизнеспособным материалом для расщепления воды PEC.[17]
Висмут ванадат
С более узкой, прямой запрещенной зоной (2,4 эВ) и правильным выравниванием полос с потенциалом окисления воды моноклинная форма BiVO
4 вызвал интерес исследователей.[17] Со временем было показано, что V-богатый[21] и компактные фильмы[22] связаны с более высоким фототоком или более высокими характеристиками. Ванадат висмута также изучался на предмет солнечной поколение из морской воды[23], что намного труднее из-за наличия загрязняющих ионов и более агрессивной коррозионной среды.
Форма окисления
Фотоэлектрохимическое окисление (PECO) - это процесс, с помощью которого свет позволяет полупроводник продвигать каталитическое окисление реакция. Хотя фотоэлектрохимическая ячейка обычно включает в себя как полупроводник (электрод), так и металл (противоэлектрод), при достаточно малых масштабах чистые полупроводниковые частицы могут вести себя как микроскопические фотоэлектрохимические ячейки.[требуется разъяснение ] PECO находит применение в детоксикации воздуха и воды, производстве водорода и других применениях.
Механизм реакции
Процесс, посредством которого фотон непосредственно инициирует химическую реакцию, известен как фотолиз; если этому процессу способствует катализатор, он называется фотокатализ.[24] Если фотон имеет больше энергии, чем характерная ширина запрещенной зоны материала, он может освободить электрон при поглощении материалом. Оставшаяся положительно заряженная дырка и свободный электрон могут рекомбинировать, выделяя тепло, или они могут принимать участие в фотореакциях с соседними частицами. Если фотореакции с этими частицами приводят к регенерации электронодонорного материала, т. Е. Если материал действует как катализатор реакций, тогда реакции считаются фотокаталитическими. PECO представляет собой тип фотокатализа, при котором электрохимия на основе полупроводников катализирует реакцию окисления - например, окислительную деградацию переносимых по воздуху загрязнителей в системах очистки воздуха.
Основная цель фотоэлектрокатализа заключается в обеспечении низкоэнергетических путей активации для прохождения электронных носителей заряда через поверхность раздела электрод-электролит и, в частности, для фотоэлектрохимического образования химических продуктов.[25] Что касается фотоэлектрохимического окисления, мы можем рассмотреть, например, следующую систему реакций, которые составляют TiO2-катализируемое окисление.[26]
- TiO2 (hv) → TiO2 (е− + ч+)
- TiO2(час+) + RX → TiO2 + RX.+
- TiO2(час+) + H2O → TiO2 + HO. + H+
- TiO2(час+) + ОН− → TiO2 + HO.
- TiO2(е−) + O2 → TiO2 + O2.−
Эта система демонстрирует ряд путей образования окислительных частиц, которые облегчают окисление частиц RX, в дополнение к его прямому окислению возбужденным TiO.2 сам. PECO касается такого процесса, при котором электронные носители заряда могут легко перемещаться через реакционную среду, тем самым до некоторой степени смягчая реакции рекомбинации, которые ограничивают окислительный процесс. «Фотоэлектрохимическая ячейка» в этом случае может быть такой же простой, как очень маленькая частица полупроводникового катализатора. Здесь на «светлой» стороне окисляется один вид, а на «темной» стороне восстанавливается отдельный вид.[27]
Фотохимическое окисление (PCO) по сравнению с PECO
Классическая макроскопическая фотоэлектрохимическая система состоит из полупроводника, находящегося в электрическом контакте с противоэлектродом. За Полупроводник N-типа частиц достаточно малого размера, частицы поляризуются на анодную и катодную области, эффективно формируя микроскопические фотоэлектрохимические ячейки.[25] Освещенная поверхность частицы катализирует фотоокисление реакция, а «темная» сторона частицы способствует сопутствующему восстановлению.[28]
Фотоэлектрохимическое окисление можно рассматривать как частный случай фотохимического окисления (ФКО). Фотохимическое окисление влечет за собой образование радикалов, которые делают возможной реакции окисления, с электрохимическими взаимодействиями, участвующими в системах с полупроводниковыми катализаторами, которые происходят при фотоэлектрохимическом окислении, или без них.[требуется разъяснение ]
Приложения
PECO может быть полезен при обработке как воздуха, так и воды.[29][30]
История
В 1938 году Гудив и Китченер продемонстрировали «фотосенсибилизацию» TiO.2- например, о чем свидетельствует обесцвечивание красок, содержащих его в качестве пигмента.[31] В 1969 году Кинни и Ивануски предположили, что различные оксиды металлов, в том числе TiO2, может катализировать окисление растворенных органических материалов (фенола, бензойной кислоты, уксусной кислоты, стеарата натрия и сахарозы) при освещении солнечными лампами.[29] Дополнительная работа Carey et al. предположил, что TiO2 может быть полезно для фотодехлорирования ПХД.[32]
дальнейшее чтение
- Гуревич И. У., Плесков И. У., Ротенберг З. А. Фотоэлектрохимия. Нью-Йорк: Бюро консультантов, 1980.
- М. Скьявелло, Фотоэлектрохимия, фотокатализ и фотореакторы: основы и разработки. Дордрехт: Рейдел, 1985.
- А. Дж. Бард, М. Стратманн и С. Лихт, Энциклопедия электрохимии, том 6, Полупроводниковые электроды и фотоэлектрохимия: Wiley, 2002.
Смотрите также
Рекомендации
- ^ Джон А. Тернер; и другие. (2007-05-17). «Фотоэлектрохимические водные системы для производства H2» (PDF). Национальная лаборатория возобновляемых источников энергии. Архивировано из оригинал (PDF) на 2011-06-11. Получено 2011-05-02.
- ^ а б «Кремний / никелевый водоразделитель может привести к более дешевому водороду». Gizmag.com. Получено 2013-12-29.
- ^ Беринштейн, Паула (30.06.2001). Альтернативная энергия: факты, статистика и проблемы. Издательская группа "Гринвуд". ISBN 1-57356-248-3.
Другой фотоэлектрохимический метод включает использование растворенных комплексов металлов в качестве катализатора, который поглощает энергию и создает разделение электрических зарядов, которое запускает реакцию расщепления воды.
- ^ Deutsch, T. G .; Head, J. L .; Тернер, Дж. А. (2008). «Фотоэлектрохимические характеристики и анализ долговечности эпитаксиальных слоев GaInPN». Журнал Электрохимического общества. 155 (9): B903. Bibcode:2008JELS..155B.903D. Дои:10.1149/1.2946478.
- ^ Брэд Пламмер (10 августа 2006 г.). «Микроскопическое решение огромной проблемы». SLAC сегодня. Национальная ускорительная лаборатория SLAC. Получено 2011-05-02.
- ^ Wang, H .; Deutsch, T .; Тернер, Дж. А. А. (2008). «Прямое разделение воды в видимом свете с помощью наноструктурированного фотоанода и фотокатода GaInP2». Транзакции ECS. 6 (17): 37. Bibcode:2008ECSTr ... 6q..37Вт. Дои:10.1149/1.2832397.
- ^ https://www.pveducation.org/pvcdrom/manufacturing/first-photovoltaic-devices
- ^ Трык, Д .; Фудзисима, А; Хонда, К. (2000). «Актуальные темы фотоэлектрохимии: достижения и перспективы». Electrochimica Acta. 45 (15–16): 2363–2376. Дои:10.1016 / S0013-4686 (00) 00337-6.
- ^ Зейтц, Линси (26 февраля 2019 г.), Лекция 13: Солнечное топливо (Слайды лекций, Введение в электрохимию CHE 395)
| формат =требует| url =(помощь), Северо-Западный университет - ^ А. Фудзисима, К. Хонда, С. Кикучи, Когио Кагаку Дзасси 72 (1969) 108–113
- ^ De Haart, L .; De Vries, A.J .; Блассе, Г. (1985). «О фотолюминесценции полупроводниковых титанатов, применяемых в фотоэлектрохимических ячейках». Журнал химии твердого тела. 59 (3): 291–300. Bibcode:1985JSSCh..59..291D. Дои:10.1016/0022-4596(85)90296-8.
- ^ Cao, F .; Oskam, G .; Meyer, G.J .; Сирсон, П. С. (1996). «Электронный транспорт в пористых нанокристаллических фотоэлектрохимических ячейках TiO2». Журнал физической химии. 100 (42): 17021–17027. Дои:10.1021 / jp9616573.
- ^ Wang, D .; Pierre, A .; Kibria, M. G .; Cui, K .; Хан, X .; Bevan, K. H .; Guo, H .; Paradis, S .; Hakima, A. R .; Ми, З. (2011). "Фотокаталитическое расщепление воды на уровне пластин на решетках из GaN-нанопроволок, выращенных методом молекулярно-лучевой эпитаксии". Нано буквы. 11 (6): 2353–2357. Bibcode:2011NanoL..11.2353W. Дои:10.1021 / nl2006802. PMID 21568321.
- ^ Юнг, Хе Сон; Ён Джун Хонг, Йируи Ли, Чонхуэй Чо, Ён-Джин Ким, Гю-Чуй Йи (2008). «Фотокатализ с использованием нанопроволок GaN». САУ Нано. 2 (4): 637–642. Дои:10.1021 / nn700320y. PMID 19206593.CS1 maint: несколько имен: список авторов (связь)
- ^ Kline, G .; Kam, K .; Canfield, D .; Паркинсон, Б. (1981). «Эффективные и стабильные фотоэлектрохимические ячейки, построенные с фотоанодами WSe2 и MoSe2». Материалы для солнечной энергии. 4 (3): 301–308. Bibcode:1981 СОЭНМ ... 4..301 тыс.. Дои:10.1016 / 0165-1633 (81) 90068-Х.
- ^ Кенни, М. Дж .; Gong, M .; Li, Y .; Wu, J. Z .; Feng, J .; Lanza, M .; Дай, Х. (2013). «Высокопроизводительные кремниевые фотоаноды, пассивированные ультратонкими пленками никеля для окисления воды». Наука. 342 (6160): 836–840. Bibcode:2013Наука ... 342..836K. Дои:10.1126 / science.1241327. PMID 24233719. S2CID 206550249.
- ^ а б c d Питер, Лори; Леверенц, Ханс-Иоахим (2 октября 2013 г.). Фотоэлектрохимическое расщепление воды: материалы, процессы и архитектура. Кембридж: Королевское химическое общество. ISBN 978-1-84973-647-3.
- ^ Иорданова, Н .; Dupuis, M .; Россо, К. М. (8 апреля 2005 г.). «Перенос заряда в оксидах металлов: теоретическое исследование гематита α-Fe2O3». Журнал химической физики. 122 (14): 144305. Bibcode:2005ЖЧФ.122н4305И. Дои:10.1063/1.1869492. PMID 15847520.
- ^ Чжун, Дайан К .; Гамелен, Дэниел Р. (31 марта 2010 г.). "Фотоэлектрохимическое окисление воды кобальтовым катализатором (" Co-Pi ") / композитные фотоаноды α-FeO: выделение кислорода и разрешение кинетического узкого места". Журнал Американского химического общества. 132 (12): 4202–4207. Дои:10.1021 / ja908730h. PMID 20201513.
- ^ Тилли, С. Дэвид; Корнуз, Маурин; Сивула, Кевин; Гретцель, Майкл (23 августа 2010 г.). «Светоиндуцированное расщепление воды с гематитом: улучшенная наноструктура и катализ оксидом иридия». Angewandte Chemie International Edition. 49 (36): 6405–6408. Дои:10.1002 / anie.201003110. PMID 20665613.
- ^ Берглунд, Шон П .; Флаэрти, Дэвид В .; Hahn, Nathan T .; Bard, Allen J .; Маллинз, К. Бадди (16 февраля 2011 г.). «Фотоэлектрохимическое окисление воды с использованием наноструктурированных пленок BiVO». Журнал физической химии C. 115 (9): 3794–3802. Дои:10.1021 / jp1109459.
- ^ Су, Цзиньчжан; Го, Леджин; Йория, Сорачон; Граймс, Крейг А. (3 февраля 2010 г.). "Водный рост массивов нанопроволоки BiVO4 пирамидальной формы и структурные характеристики: применение к фотоэлектрохимическому расщеплению воды". Рост кристаллов и дизайн. 10 (2): 856–861. Дои:10.1021 / cg9012125.
- ^ Ло, Вэньцзюнь; Ян, Зайсан; Ли, Чжаошэн; Чжан, Цзиюань; Лю, Цзяньго; Чжао, Цзунъянь; Ван, Чжицян; Ян, Шичэн; Ю, Тао; Цзоу, Чжиган (2011). «Солнечное производство водорода из морской воды с помощью модифицированного фотоанода BiVO4». Энергетика и экология. 4 (10): 4046. Дои:10.1039 / C1EE01812D.
- ^ Д. Ю. Госвами, Принципы солнечной энергетики, 3-е изд. Бока-Ратон: Тейлор и Фрэнсис, 2015.
- ^ а б Х. Трибуч, «Фотоэлектрокатализ», в фотокатализе: основы и приложения, Н. Серпоне и Э. Пелицетти, ред. Нью-Йорк: Wiley-Interscience, 1989, стр. 339-383.
- ^ О. Легрини, Э. Оливерос и А. Браун, "Фотохимические процессы для очистки воды", Chemical Reviews, vol. 93, стр. 671-698, 1993.
- ^ D. Y. Goswami, "Фотоэлектрохимическая дезинфекция воздуха" Патент США 7 063 820 B2, 2006 г.
- ^ А. Дж. Бард, "Фотоэлектрохимия и гетерогенный фотокатализ в полупроводниках", Journal of Photochemistry, вып. 10. С. 59-75, 1979.
- ^ а б Л. К. Кинни и В. Р. Ивануски, "Механизмы фотолиза для уменьшения загрязнения", 1969.
- ^ Д.Ю. Госвами, Дж. Клауснер, Г. Матур, А. Мартин, К. Шанце, П. Вайнесс и др. «Солнечная фотокаталитическая обработка грунтовых вод на авиабазе Тиндалл: результаты полевых испытаний», в Proceedings of the ... Annual Конференция Американского общества солнечной энергии, Inc., 1993.
- ^ К. Гудев и Дж. Китченер, "Фотосенсибилизация диоксидом титана", Труды Общества Фарадея, вып. 34. С. 570–579, 1938.
- ^ Дж. Х. Кэри, Дж. Лоуренс и Х. М. Тозин, "Фотодехлорирование ПХБ в присутствии диоксида титана в водных суспензиях", Бюллетень загрязнения окружающей среды и токсикологии, вып. 16. С. 697–701, 1976.

![{ Displaystyle { ce {H2O (l) + [hv] + 2h + -> 2H + (водн.) + 1 / 2O2 (g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4f2ffce31014f2c346a24c324d29dd83536942d)


