Селеноил фторид - Selenoyl fluoride
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| SeO2F2 | |
| Молярная масса | 148,95 г / моль |
| Внешность | Газ. |
| Температура плавления | -99,5 ° С (-147,1 ° F, 173,7 К)[1] |
| Точка кипения | -8,4 ° С (16,9 ° F, 264,8 К)[2] |
| Родственные соединения | |
Другой катионы | ТАК2F2 |
Родственные соединения | SeF6, SeO3 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Селеноил фторид, селеноил дифторид, оксифторид селена, или же диоксидифторид селена это химическое соединение с формула SeO2F2.
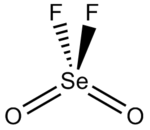
Структура
Форма молекулы представляет собой искаженный тетраэдр с углом O-Se-O, равным 126,2 °, углом O-Se-F, равным 108,0 °, и углом F-Se-F, равным 94,1 °.[3] Длина связи Se-F составляет 1,685 Å, а длина связи селена с кислородом - 1,575 Å.[4]
Формирование
Селеноилфторид может образовываться под действием теплого фторсульфоновая кислота на селенат бария[5] или же селеновая кислота. SeO3 + SeF4 может выделять этот газ вместе с другими оксифторидами.
Реакции
Селеноилфторид более реакционноспособен, чем его аналог сульфурилфторид. Его легче гидролизовать и уменьшить. Может бурно отреагировать при контакте с аммиак.
Селеноилфторид реагирует с дифторид ксенона дает FXeOSeF5.[6]
Рекомендации
- ^ CRC Справочник по химии и физике
- ^ Сеппельт, К. «Селеноил дифторид» Неорганические синтезы, 1980, том XX, стр. 36-38. ISBN 0-471-07715-1.
- ^ Вай-Ки Ли, Гонг-дю Чжоу, Томас К. В. Мак Продвинутая структурная неорганическая химия стр. 651 2008 ISBN 0-19-921694-0
- ^ Колбьёрн Хаген, Вирджиния Р. Кросс и Кеннет Хедберг "Молекулярная структура селенонилфторида, SeO2F2, и сульфурилфторид, SO2F2, как определено методом дифракции электронов в газовой фазе " Журнал молекулярной структуры 1978 том 44 выпуск 2 стр 187 Дои:10.1016/0022-2860(78)87027-6
- ^ Расширенная неорганическая химия: полный текст Коттон и Уилкинсон
- ^ https://www.scribd.com/doc/30122309/Noble-Gas-Compounds
