Уравнение Дебая – Хюккеля - Debye–Hückel equation

Химики Питер Дебай и Эрих Хюкель заметил это растворы, содержащие ионные растворенные вещества, ведут себя неидеально даже при очень низких концентрациях. Таким образом, хотя концентрация растворенных веществ имеет фундаментальное значение для расчета динамики раствора, они предположили, что дополнительный фактор, который они назвали гамма, необходим для расчета коэффициенты активности решения. Поэтому они разработали Уравнение Дебая – Хюккеля и Предельный закон Дебая-Хюккеля. Активность пропорциональна только концентрации и изменяется с помощью фактора, известного как коэффициент активности. . Этот фактор учитывает энергия взаимодействия ионов в растворе.
Предельный закон Дебая-Хюккеля
Чтобы рассчитать Мероприятия из ион C в растворе необходимо знать концентрация и коэффициент активности:
куда
- - коэффициент активности C,
- концентрация выбранных стандартное состояние, например 1 моль / кг, если моляльность используется,
- является мерой концентрации C.
Разделение с дает безразмерную величину.
В Предельный закон Дебая-Хюккеля позволяет определить коэффициент активности иона в разбавлять решение известных ионная сила. Уравнение[1]:раздел 2.5.2
куда
- это номер заряда ионных разновидностей я,
- это элементарный заряд,
- инверсия Длина дебаевского показа (определено ниже),
- это относительная диэлектрическая проницаемость растворителя,
- это диэлектрическая проницаемость свободного пространства,
- это Постоянная Больцмана,
- это температура раствора,
- это Константа Авогадро,
- это ионная сила решения (определенного ниже),
- постоянная, зависящая от температуры. Если выражается через молярность, а не молярность (как в уравнении выше и в остальной части этой статьи), то экспериментальное значение для воды является при 25 ° С. Обычно используется логарифм по основанию 10, и в этом случае мы учитываем , так А является . Множитель перед в уравнении для случая, когда размеры находятся . Когда размеры находятся , множитель должен быть исключен из уравнения.
Важно отметить, что поскольку ионы в растворе действуют вместе, коэффициент активности, полученный из этого уравнения, фактически является средним коэффициентом активности.
Избыток осмотическое давление полученная из теории Дебая – Хюккеля, находится в единицы cgs:[1]
Следовательно, полное давление - это сумма избыточного осмотического давления и идеального давления. . В осмотический коэффициент тогда дается
Резюме первой статьи Дебая и Хюккеля по теории разбавленных электролитов
Название статьи на английском языке: «К теории электролитов. I. Понижение точки замерзания и связанные с ним явления». Первоначально он был опубликован в 1923 году в 24 томе журнала на немецком языке. Physikalische Zeitschrift. Английский перевод[2]:217–63 Статья включена в сборник статей, подаренный Дебаю «его учениками, друзьями и издателями по случаю его семидесятилетия 24 марта 1954 года».[2]:xv Еще один перевод на английский язык был завершен в 2019 году.[3][4] Статья посвящена расчету свойств растворов электролитов, находящихся под воздействием ионно-индуцированных электрических полей, т.е. электростатика.
В том же году они впервые опубликовали эту статью, Дебай и Хюккель, далее D&H, также выпустили статью, в которой описывалась их первоначальная характеристика растворов, находящихся под действием электрических полей, под названием «Теория электролитов. II. Закон ограничения электропроводности». , но эта последующая статья (пока) не освещена здесь.
В следующем резюме (пока что неполном и непроверенном) используются современные обозначения и терминология как из химии, так и из математики, во избежание путаницы. Кроме того, за некоторыми исключениями для большей ясности, подразделы в этом резюме являются (очень) сокращенными версиями одних и тех же подразделов исходной статьи.
Вступление
D&H отмечают, что формула Гульдберга – Вааге для частиц электролита в равновесие химической реакции в классической форме[2]:221
куда
- это обозначение для умножение,
- это фиктивная переменная с указанием вида,
- количество видов, участвующих в реакции,
- это мольная доля видов ,
- это стехиометрический коэффициент видов ,
- K это константа равновесия.
D&H говорят, что из-за «взаимных электростатических сил между ионами» необходимо модифицировать уравнение Гульдберга – Вааге, заменив с , куда это общий коэффициент активности, а не "особый" коэффициент активности (отдельный коэффициент активности, связанный с каждым видом) - что используется в современной химии с 2007 г.[Обновить].
Отношения между и коэффициенты специальной активности является[2]:248
Основы
D&H использует Свободные энтропии Гельмгольца и Гиббса и чтобы выразить влияние электростатических сил в электролите на его термодинамическое состояние. В частности, они разделили большую часть термодинамические потенциалы на классические и электростатические термины:
куда
- является Свободная энтропия Гельмгольца,
- является энтропия,
- является внутренняя энергия,
- является температура,
- является Свободная энергия Гельмгольца.
D&H дает полный дифференциал из в качестве[2]:222
куда
По определению полного дифференциала это означает, что
которые пригодятся в дальнейшем.
Как было сказано ранее, внутренняя энергия делится на две части:[2]:222
куда
- указывает на классическую часть,
- указывает электрическую часть.
Точно так же свободная энтропия Гельмгольца также делится на две части:
D&H заявляют, не вдаваясь в логику, что[2]:222
Казалось бы, без какого-либо обоснования
Не упоминая об этом конкретно, D&H позже дает то, что может быть требуемым (выше) обоснованием, утверждая, что , предположение несжимаемости растворителя.
Определение Свободная энтропия Гиббса является[2]:222–3
куда является Свободная энергия Гиббса.
D&H дают общую разницу в качестве[2]:222
На этом этапе D&H отмечает, что для воды, содержащей 1 моль на литр хлорид калия (номинальное давление и температура не указаны), электрическое давление составляет 20 атмосфер. Кроме того, они отмечают, что этот уровень давления дает относительное изменение объема на 0,001. Поэтому они пренебрегают изменением объема воды из-за электрического давления, записывая[2]:223
и положи
D&H говорят, что, согласно Планку, классическая часть свободной энтропии Гиббса равна[2]:223
куда
- это вид,
- - количество различных типов частиц в растворе,
- количество частиц вида я,
- - свободная энтропия Гиббса частиц я,
- это Постоянная Больцмана,
- это мольная доля частиц я.
Нулевой вид - это растворитель. Определение выглядит следующим образом, где строчные буквы обозначают специфические для частицы версии соответствующих расширенных свойств:[2]:223
D&H так не говорит, но функциональная форма для может быть получено из функциональной зависимости химического потенциала компонента идеальная смесь от его мольной доли.[5]
D&H отмечают, что внутренняя энергия раствора уменьшается из-за электрического взаимодействия его ионов, но этот эффект не может быть определен с помощью кристаллографического приближения для расстояний между разнородными атомами (кубический корень из отношения общего объема к количеству частиц в объеме ). Это потому, что в жидком растворе больше теплового движения, чем в кристалле. Тепловое движение имеет тенденцию размывать естественную решетку, которая в противном случае была бы построена ионами. Вместо этого D&H вводит концепцию ионная атмосфера или облако. Подобно кристаллической решетке, каждый ион все еще пытается окружить себя противоположно заряженными ионами, но в более свободной форме; на малых расстояниях от положительных ионов больше шансов найти отрицательные ионы, и наоборот.[2]:225
Потенциальная энергия произвольного ионного раствора
Электронейтральность решения требует, чтобы[2]:233
куда
- это общее количество ионов вида я в растворе,
- это номер заряда видов я.
Чтобы принести ион видов ясначала далеко, в точку внутри ионного облака требует энергия взаимодействия в количестве , куда это элементарный заряд, и это значение скаляра электрический потенциал поле в . Если бы электрические силы были единственным действующим фактором, конфигурация всех ионов с минимальной энергией была бы достигнута в конфигурации решетки с плотной упаковкой. Однако ионы находятся в тепловое равновесие друг с другом и относительно свободно перемещаются. Таким образом они подчиняются Статистика Больцмана и сформировать Распределение Больцмана. Все виды ' числовые плотности изменяются от их общих (общих средних) значений соответствующими Фактор Больцмана , куда это Постоянная Больцмана, и это температура.[6] Таким образом, в каждой точке облака[2]:233
Обратите внимание, что в пределе бесконечной температуры все ионы распределены равномерно, без учета их электростатических взаимодействий.[2]:227
В плотность заряда связана с числовой плотностью:[2]:233
При объединении этого результата для плотности заряда с Уравнение Пуассона от электростатики, форма Уравнение Пуассона – Больцмана. полученные результаты:[2]:233
Это уравнение сложно решить и не следует принципу линейная суперпозиция для связи между количеством зарядов и напряженностью потенциального поля. Это было решено шведским математиком. Томас Хакон Гронвалл и его соавторы, физики-химики В. К. Ла Мер и Карл Сандвед в статье 1928 г. Physikalische Zeitschrift занимаются расширениями теории Дебая – Хюккеля, которые прибегают к разложению в ряды Тейлора.
Однако при достаточно низких концентрациях ионов первый порядок Расширение ряда Тейлора можно использовать приближение для экспоненциальной функции ( за ) для создания линейного дифференциального уравнения (Hamann, Hamnett, and Vielstich. Electrochemistry. Wiley-VCH. раздел 2.4.2). D&H говорят, что это приближение справедливо на больших расстояниях между ионами,[2]:227 что то же самое, что сказать, что концентрация низкая. Наконец, они без доказательств заявляют, что добавление дополнительных членов в расширение мало влияет на окончательное решение.[2]:227 Таким образом
Уравнение Пуассона – Больцмана преобразуется к виду[2]:233
потому что первое суммирование равно нулю из-за электронейтральности.[2]:234
Вынесите скалярный потенциал за скобки и назначьте остатки, которые постоянны, на . Кроме того, пусть быть ионная сила решения:[2]:234
Итак, основное уравнение сводится к виду Уравнение Гельмгольца:[7]
Сегодня, называется Длина дебаевского показа. D&H признают важность этого параметра в своей статье и характеризуют его как меру толщины ионной атмосферы, которая является двойной электрический слой типа Гуи – Чепмена.[2]:229
Уравнение может быть выражено в сферические координаты принимая на некотором произвольном ионе:[8][2]:229
Уравнение имеет следующее общее решение (учтите, что положительная постоянная):[2]:229
куда , , и неопределенные константы
Электрический потенциал равен нулю на бесконечности по определению, поэтому должно быть равно нулю.[2]:229
На следующем этапе D&H предполагает наличие определенного радиуса , за пределами которого никакие ионы в атмосфере не могут приблизиться к (зарядовому) центру выделенного иона. Этот радиус может быть связан с физическим размером самого иона, размерами ионов в облаке и любыми молекулами воды, которые окружают ионы. Математически они рассматривают выделенный ион как точечный заряд к которому нельзя приближаться в радиусе .[2]:231
Потенциал точечного заряда сам по себе равен
D&H говорят, что общий потенциал внутри сферы равен[2]:232
куда - константа, которая представляет собой потенциал, добавленный ионной атмосферой. Нет оправдания для дается константа. Однако можно увидеть, что это так, если учесть, что любое сферическое распределение статического заряда подчиняется математике теорема оболочек. Теорема оболочек гласит, что на заряженные частицы внутри сферы (произвольного заряда) не действует сила.[9] Поскольку ионная атмосфера считается (усредненной по времени) сферически-симметричной, с изменением заряда в зависимости от радиуса , его можно представить в виде бесконечного ряда концентрических оболочек заряда. Следовательно, внутри радиуса , ионная атмосфера не действует. Если сила равна нулю, то потенциал постоянен (по определению).
В сочетании модели непрерывного распределения, которая дала уравнение Пуассона – Больцмана, и модели точечного заряда, предполагается, что на радиусе , есть преемственность и его первая производная. Таким образом[2]:232
По определению электрическая потенциальная энергия, потенциальная энергия, связанная с выделенным ионом в ионной атмосфере, равна[2]:230 & 232
Обратите внимание, что для этого нужно знать только заряд выделенного иона и потенциал всех остальных ионов.
Чтобы вычислить потенциальную энергию всего раствора электролита, необходимо использовать многозарядное обобщение для электрической потенциальной энергии:[2]:230 & 232
Дополнительный электрический член к термодинамическому потенциалу
Эта статья отсутствует информация о еще не добавленных. (Май 2018) |
Обезразмеривание
Дифференциальное уравнение готово к решению (как указано выше, уравнение справедливо только для низких концентраций):
С использованием Теорема Букингема π по этой проблеме приводит к следующим безразмерным группам:
называется приведенным скалярным электрическим потенциальным полем. называется приведенным радиусом. Существующие группы могут быть повторно объединены для образования двух других безразмерных групп для подстановки в дифференциальное уравнение. Первый - это то, что можно назвать квадратом приведенного обратная длина просеивания, . Вторую можно назвать уменьшенным центральным зарядом иона, (с большой буквы). Обратите внимание, что, хотя уже безразмерно, без подстановки, приведенной ниже, дифференциальное уравнение все равно будет размерным.
Чтобы получить безразмерное дифференциальное уравнение и начальные условия, используйте группы для устранения в пользу , затем исключите в пользу при выполнении цепного правила и подстановки , затем исключите в пользу (правило цепочки не требуется), затем удалите в пользу , затем исключите в пользу . В результате получаются следующие уравнения:
Для поваренной соли в 0,01 М растворе при 25 ° C типичное значение составляет 0,0005636, а типичное значение составляет 7,017, что подчеркивает тот факт, что в низких концентрациях является целью для приближения нулевого порядка, такого как анализ возмущений. К сожалению, из-за граничного условия на бесконечности регулярное возмущение не работает. Это же граничное условие не позволяет нам найти точное решение уравнений. Однако сингулярное возмущение может работать.
Экспериментальная проверка теории
Чтобы проверить справедливость теории Дебая-Хюккеля, было испробовано множество экспериментальных способов измерения коэффициентов активности: проблема в том, что нам нужно перейти к очень высоким разбавлениям. Типичными примерами являются: измерения давления пара, точки замерзания, осмотического давления (косвенные методы) и измерение электрического потенциала в клетках (прямой метод). При переходе к высоким разведениям были получены хорошие результаты с использованием жидких мембранных клеток, стало возможным исследовать водные среды 10−4 M, и было обнаружено, что для электролитов 1: 1 (таких как NaCl или KCl) уравнение Дебая-Хюккеля полностью верно, но для электролитов 2: 2 или 3: 2 можно найти отрицательное отклонение от предела Дебая-Хюккеля. закон: это странное поведение может наблюдаться только в очень разбавленной области, а в более концентрированных областях отклонение становится положительным. Возможно, что уравнение Дебая – Хюккеля не может предвидеть такое поведение из-за линеаризации уравнения Пуассона – Больцмана , а может и нет: исследования по этому поводу были начаты только в последние годы 20-го века, потому что раньше было невозможно исследовать 10−4 M области, поэтому не исключено, что в ближайшие годы родятся новые теории.
Расширения теории
Был предложен ряд подходов, позволяющих распространить действие закона на диапазоны концентраций, которые обычно встречаются в химии.
Одно такое расширенное уравнение Дебая – Хюккеля имеет вид:
куда как его десятичный логарифм - коэффициент активности, - целочисленный заряд иона (1 для H+, 2 для Mg2+ так далее.), - ионная сила водного раствора, а это размер или эффективный диаметр иона в ангстрем. Эффективный гидратированный радиус иона a - это радиус иона и его тесно связанных молекул воды. Большие ионы и менее заряженные ионы менее прочно связывают воду и имеют меньший радиус гидратации, чем более мелкие и более заряженные ионы. Типичные значения для ионов, таких как H, составляют 3 Å.+, Cl−, CN−, и HCOO−. Эффективный диаметр для ион гидроксония составляет 9Å. и - константы со значениями соответственно 0,5085 и 0,3281 при 25 ° C в воде. [2].
Расширенное уравнение Дебая – Хюккеля дает точные результаты для μ ≤ 0,1. Для растворов с большей ионной силой Уравнения Питцера должен быть использован. В этих растворах коэффициент активности может фактически увеличиваться с увеличением ионной силы.
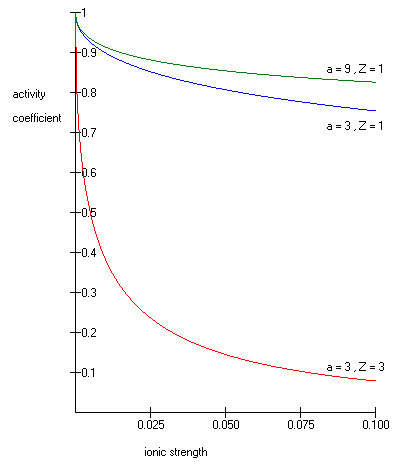
Уравнение Дебая – Хюккеля нельзя использовать в решениях поверхностно-активные вещества где наличие мицеллы влияет на электрохимические свойства системы (даже грубая оценка дает переоценку γ на ~ 50%).
Смотрите также
- Сильный электролит
- Слабый электролит
- Ионная атмосфера
- Теория Дебая-Хюккеля
- Уравнение Пуассона – Больцмана.
Примечания
- ^ http://homepages.rpi.edu/~keblip/THERMO/chapters/Chapter33.pdf, стр.9.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф Собрание статей Питера Дж. У. Дебая. Нью-Йорк, Нью-Йорк: Interscience Publishers, Inc. 1954.
- ^ П. Дебай и Э. Хюкель (1923). "Zur Theorie der Elektrolyte. I. Gefrierpunktserniedrigung und verwandte Erscheinungen". Physikalische Zeitschrift. 24: 185–206.
- ^ П. Дебай и Э. Хюкель (1923). «Теория электролитов. 1. Понижение точки замерзания и связанные с ним явления. Перевод Майкла Дж. Брауса (2020)». Physikalische Zeitschrift. 24: 185–206.
- ^ Зальцман, Уильям Р. (21 августа 2001 г.). «Смеси; частичные молярные количества; идеальные решения». Химическая термодинамика. Университет Аризоны. Архивировано из оригинал на 2007-06-07. Получено 2007-10-23.
- ^ http://www.pma.caltech.edu/Courses/ph136/yr2006/text.html В архиве 2007-08-28 на Wayback Machine, раздел 19.3
- ^ http://guava.physics.uiuc.edu/~nigel/courses/569/Essays_2004/files/lu.pdf раздел 3.1)
- ^ http://hyperphysics.phy-astr.gsu.edu/hbase/electric/laplace.html
- ^ http://hyperphysics.phy-astr.gsu.edu/hbase/electric/potsph.html
Рекомендации
- П. Дебай; Э. Хюкель (1923). "Zur Theorie der Elektrolyte. I. Gefrierpunktserniedrigung und verwandte Erscheinungen" [Теория электролитов. I. Понижение точки замерзания и связанные с ним явления] (PDF). Physikalische Zeitschrift. 24: 185–206.[постоянная мертвая ссылка ]
- ^ Хаманн, Хамнетт и Вильстих (1998). Электрохимия. Вайнхайм: Wiley-VCH Verlag GmbH. ISBN 3-527-29096-6.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Харрис, Дэниел С. (2003). Количественный химический анализ (6-е изд.). В. Х. Фриман и компания. ISBN 0-7167-4464-3.
- ^ Скуг, Дуглас А. Основы аналитической химии. ISBN 0-534-41796-5.
- Ф. Малатеста, Р. Замбони. Активность и осмотические коэффициенты от ЭДС жидких мембранных клеток, VI - ZnSO4, MgSO4, CaSO4 и SrSO4 в воде при 25 C. Журнал химии растворов 1997, 26, 791–815
внешняя ссылка
- Чтобы легко рассчитать коэффициенты активности в (немицеллярных) растворах, ознакомьтесь с Открытый проект IUPAC Aq-solutions[постоянная мертвая ссылка ] (бесплатное ПО).
- Золотая книга определение[постоянная мертвая ссылка ]



![{ displaystyle a_ {C} = gamma { frac {[C]} {[C ^ { ominus}]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4022edef5c1cba965b065d914671e5910db1e92f)
![{ Displaystyle [С ^ { ominus}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca7090587b8389d00b92da68ea39d6df16586c77)
![[C]](https://wikimedia.org/api/rest_v1/media/math/render/svg/798adf333080234dd9da202633a4d63c4ea091aa)
























































































































