Озон - Ozone
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Trioxygen | |||
| Другие имена 2λ4-триоксидиен; катена-триоксиген | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.051 | ||
| Номер ЕС |
| ||
| 1101 | |||
| MeSH | Озон | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| О3 | |||
| Молярная масса | 47.997 г · моль−1 | ||
| Внешность | От бесцветного до бледно-голубого газа[1] | ||
| Запах | Острый[1] | ||
| Плотность | 2,144 мг · см−3 (при 0 ° C) | ||
| Температура плавления | -192,2 ° С; -313,9 ° F; 81.0 К | ||
| Точка кипения | -112 ° С; -170 ° F; 161 К | ||
| 1.05 г л−1 (при 0 ° C) | |||
| Растворимость в других растворителях | Очень растворим в CCl4, серная кислота | ||
| Давление газа | 55,7 атм[2] (-12,15 ° C или 10,13 ° F или 261,00 K)[а] | ||
| +6.7·10−6 см3/ моль | |||
| 1,2226 (жидкость), 1.00052 (газ, стандартное давление, 546 нм - обратите внимание на высокую дисперсию)[3] | |||
| Структура | |||
| C2v | |||
| Дигональный | |||
| Двугранный | |||
| Гибридизация | зр2 для O1 | ||
| 0,53 D | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 238,92 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 142,67 кДж моль−1 | ||
| Опасности | |||
| Пиктограммы GHS |      | ||
| Сигнальное слово GHS | Опасность | ||
| H270, H314, H318 | |||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LCLo (самый низкий опубликованный ) | 12,6 частей на миллион (мышь, 3 часа) 50 частей на миллион (человек, 30 мин) 36 частей на миллион (кролик, 3 часа) 21 частей на миллион (мышь, 3 часа) 21,8 частей на миллион (крыса, 3 часа) 24,8 частей на миллион (морская свинка, 3 часа) 4,8 частей на миллион (крыса, 4 часа)[4] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 0,1 частей на миллион (0,2 мг / м3)[1] | ||
REL (Рекомендуемые) | C 0,1 частей на миллион (0,2 мг / м3)[1] | ||
IDLH (Непосредственная опасность) | 5 частей на миллион[1] | ||
| Родственные соединения | |||
Родственные соединения | Диоксид серы Трисера Монооксид дисеры Циклический озон | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Озон (/ˈoʊzoʊп/), или же триоксиген, неорганический молекула с химическая формула О
3. Это бледно-голубой газ с характерным острый запах. Это аллотроп из кислород это гораздо менее стабильно, чем двухатомный аллотроп О
2, распадаясь в нижних слоях атмосферы на О
2 (дикислород ). Озон образуется из двуокиси кислорода под действием ультрафиолетовый (УФ) свет и электрические разряды внутри Атмосфера Земли. Он присутствует в очень низких концентрациях повсюду, а его самая высокая концентрация высока в озоновый слой из стратосфера, который поглощает большую часть солнце ультрафиолетовое (УФ) излучение.
Запах озона напоминает запах хлор, и обнаруживается многими людьми при концентрациях всего лишь 0.1 промилле в воздухе. Озон O3 структура была определена в 1865 году. Позже было доказано, что молекула имеет изогнутую структуру и слабо парамагнитный. В стандартные условия, озон - это бледно-голубой газ, который при криогенных температурах конденсируется до темно-синего цвета. жидкость и наконец фиолетово-черный твердый. Нестабильность озона по отношению к более распространенному дикислоду такова, что и концентрированный газ, и жидкий озон могут взрывоопасно разлагаться при повышенных температурах или быстром нагревании до точки кипения.[5]Поэтому он коммерчески используется только в низких концентрациях.
Озон - мощный окислитель (гораздо больше, чем дикислород ) и имеет множество промышленных и бытовых применений, связанных с окислением. Однако такой же высокий окислительный потенциал вызывает повреждение озоном слизистых и дыхательных тканей у животных, а также тканей растений при концентрациях выше примерно 0,1 частей на миллион. Хотя это делает озон потенциально опасным для дыхательных путей и загрязняющим веществом вблизи уровня земли, более высокая концентрация в озоновом слое (от двух до восьми частей на миллион) является полезной, предотвращая попадание вредного ультрафиолетового света на поверхность Земли.
Номенклатура
В банальное имя озон является наиболее часто используемым и предпочтительное название ИЮПАК. Систематические названия 2λ4-триоксидиен[сомнительный ] и катена-триоксиген, действительный ИЮПАК имена, построены согласно заместительной и аддитивной номенклатуре соответственно. Название озон происходит от озеин (ὄζειν), Греческий глагол для запаха, относящийся к отличительному запаху озона.
В соответствующих контекстах озон можно рассматривать как триоксидан с двумя удаленными атомами водорода, и как таковой, триоксиданилиден может использоваться в качестве систематического названия согласно заместительной номенклатуре. По умолчанию в этих названиях не учитывается радикальность молекулы озона. В еще более конкретном контексте это также можно назвать нерадикальным синглетным основным состоянием, тогда как бирадикальное состояние называется триоксидандиил.
Триоксидандиил (или же озонид) используется, не систематически, для обозначения группы заместителя (-OOO-). Следует проявлять осторожность, чтобы не путать название группы с контекстно-зависимым названием озона, указанным выше.
История


В 1785 г. голландский химик Мартинус ван Марум проводил эксперименты по искровому разряду над водой, когда заметил необычный запах, который он приписал электрическим реакциям, не осознавая, что он действительно создал озон.[6]
Полвека спустя Кристиан Фридрих Шёнбейн заметил такой же резкий запах и узнал в нем запах, часто следующий за молния. В 1839 году ему удалось выделить газообразное химическое вещество и назвать его «озон» от греческого слова озеин (ὄζειν), что означает «нюхать».[7][8]По этой причине Шёнбейну обычно приписывают открытие озона.[9][10][11][6] Формула озона, O3, не был определен до 1865 г. Жак-Луи Соре[12] и подтверждено Шенбейном в 1867 году.[7][13]
На протяжении большей части второй половины девятнадцатого века и вплоть до двадцатого века натуралисты и любители здоровья считали озон здоровым компонентом окружающей среды. Бомонт, Калифорния Официальным слоганом было «Бомонт: озоновая зона», о чем свидетельствуют открытки и фирменные бланки Торговой палаты.[14] Натуралисты, работающие на открытом воздухе, часто считали, что возвышенности полезны из-за содержания в них озона. «Здесь совершенно другая атмосфера [на большой высоте] с достаточным количеством озона для поддержания необходимой энергии [для работы]», - писал натуралист. Генри Хеншоу, работаю на Гавайях.[15] Приморский воздух считался здоровым из-за содержания в нем озона; но на самом деле запах, вызывающий это убеждение, - это запах галогенированных метаболитов морских водорослей.[16]
Похоже, что озон во многом привлекателен благодаря его «свежему» запаху, который вызывал ассоциации с очищающими свойствами. Однако ученые отметили его вредное воздействие. В 1873 г. Джеймс Дьюар и Джон Грей МакКендрик задокументировано, что лягушки становились вялыми, птицы задыхались, а в крови кроликов наблюдалось снижение уровня кислорода после воздействия «озонированного воздуха», который «оказывал разрушительное действие».[17][9] Сам Шёнбейн сообщил, что боли в груди, раздражение слизистые оболочки затруднение дыхания возникло в результате вдыхания озона, и мелкие млекопитающие погибли.[18] В 1911 г. Леонард Хилл и Мартин Флэк заявлено в Труды Королевского общества B что полезные для здоровья эффекты озона «простым повторением стали неотъемлемой частью всеобщего убеждения; тем не менее, точных физиологических доказательств в пользу его положительных эффектов до сих пор почти полностью не хватало ... Единственное полностью достоверное знание о физиологическом эффекте. озона, достигнутого к настоящему времени, заключается в том, что он вызывает раздражение и «отек легких, а также смерть при вдыхании в относительно высокой концентрации в течение любого времени».[9][19]
В течение Первая Мировая Война, озон испытан при Военный госпиталь королевы Александры в Лондоне как возможный дезинфицирующее средство для ран. Газ применяли непосредственно к ранам на срок до 15 минут. Это привело к повреждению как бактериальных клеток, так и тканей человека. Другие методы дезинфекции, такие как орошение антисептики, были сочтены предпочтительными.[9][20]
Физические свойства
Озон - это бесцветный или бледно-голубой газ, слабо растворимый в воде и гораздо более растворимый в инертных неполярных растворителях, таких как четыреххлористый углерод или фторуглероды, в которых он образует голубой раствор. При 161 К (-112 ° C; -170 ° F) он конденсируется с образованием темно-синего цвета. жидкость. Давать этой жидкости нагреваться до точки кипения опасно, поскольку как концентрированный газообразный озон, так и жидкий озон могут взорваться. При температуре ниже 80 К (-193,2 ° C; -315,7 ° F) он образует фиолетово-черный цвет. твердый.[21]
Большинство людей могут обнаружить около 0,01 мкмоль / моль озона в воздухе, где он имеет очень специфический резкий запах, несколько напоминающий хлорный отбеливатель. Воздействие от 0,1 до 1 мкмоль / моль вызывает головные боли, жжение в глазах и раздражение дыхательных путей.[22]Даже низкие концентрации озона в воздухе очень разрушительны для органических материалов, таких как латекс, пластмассы и ткани легких животных.
Озон слабо парамагнитный.
Структура
Согласно экспериментальным данным из микроволновая спектроскопия, озон - изогнутая молекула, причем C2v симметрия (аналогично воды молекула). Расстояния O - O равны 127,2вечера (1.272 Å ). Угол O - O - O составляет 116,78 °.[23] Центральный атом зр² гибридизирован с одной неподеленной парой. Озон - это полярная молекула с дипольный момент из 0,53 D.[24] Молекулу можно представить в виде резонанс гибрид с двумя участвующими структурами, каждая с одинарная облигация с одной стороны и двойная связь с другой. Композиция имеет комбинезон. ордер на облигации 1,5 с обеих сторон. это изоэлектронный с нитрит-анион. Озон может состоять из замещенных изотопов (16О, 17О, 18О).

Реакции
Озон - один из самых мощных окисляющий известные агенты, намного сильнее, чем O2. Он также нестабилен при высоких концентрациях, разлагаясь на обычный кислород. Его период полураспада меняется в зависимости от атмосферных условий, таких как температура, влажность и движение воздуха. В лабораторных условиях время полураспада (HLT) в среднем составляет ~ 1500 минут (25 часов) в Все еще воздух комнатной температуры (24 ° C), нуль влажность с нуль воздухообмен в час (ACH).[25] Таким образом, в типичных офисных или домашних условиях, где воздухообмен в час варьируется от 5 до 8 ACH,[26] Озон имеет период полураспада всего тридцать минут.[27]
- 2 О
3 → 3 О
2
Эта реакция протекает быстрее с повышением температуры. Дефлаграция озона может быть вызвано искрой и может произойти при концентрации озона 10 вес% или выше.[28]
Озон также можно производить из кислорода на аноде электрохимической ячейки. Эта реакция может создавать меньшие количества озона для исследовательских целей.[29]
- О
3(г) + 2Н+ + 2e− ⇌ О
2(г) + ЧАС
2О E° = 2,075 В [30]
Это можно наблюдать как нежелательную реакцию в газовом аппарате Хоффмана во время электролиза воды, когда напряжение устанавливается выше необходимого напряжения.
Металлами
Озон окисляется больше всего металлы (Кроме золото, платина, и иридий ) к оксиды металлов в их высшем степень окисления. Например:
- Cu + О
3 → CuO + О
2
- Ag + О
3 → Назад + О
2
С соединениями азота и углерода
Озон также окисляет оксид азота к диоксид азота:
- НЕТ + О
3 → НЕТ
2 + О
2
Эта реакция сопровождается хемилюминесценция. В НЕТ
2 может быть дополнительно окислен до нитратный радикал:
- НЕТ
2 + О
3 → НЕТ
3 + О
2
В НЕТ
3 образованный может реагировать с НЕТ
2 формировать N
2О
5.
Твердый перхлорат нитрония можно сделать из НЕТ2, ClO2, и О
3 газы:
- НЕТ
2 + ClO
2 + 2 О
3 → НЕТ
2ClO
4 + 2 О
2
Озон не реагирует с аммонием. соли, но окисляется аммиак к нитрат аммония:
- 2 NH
3 + 4 О
3 → NH
4НЕТ
3 + 4 О
2 + ЧАС
2О
Озон реагирует с углерод формировать углекислый газ, даже при комнатной температуре:
- C + 2 О
3 → CO
2 + 2 О
2
С соединениями серы
Озон окисляется сульфиды к сульфаты. Например, сульфид свинца (II) окисляется до сульфат свинца (II):
- PbS + 4 O3 → PbSO4 + 4 O2
Серная кислота может производиться из озона, воды и любых элементарных сера или же диоксид серы:
- S + H2О + О3 → H2ТАК4
- 3 так2 + 3 часа2О + О3 → 3 H2ТАК4
в газовая фаза, озон реагирует с сероводород с образованием диоксида серы:
- ЧАС2S + O3 → ТАК2 + H2О
В водный раствор, однако, происходят две конкурирующие одновременные реакции: одна с образованием элементарной серы, а другая с образованием серная кислота:
- ЧАС2S + O3 → S + O2 + H2О
- 3 ч2S + 4 O3 → 3 H2ТАК4
С алкенами и алкинами
Алкены могут окислительно расщепляться озоном в процессе, называемом озонолиз, давая спирты, альдегиды, кетоны и карбоновые кислоты, в зависимости от второй стадии обработки.
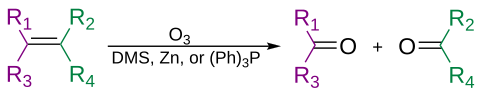
Озон также может расщеплять алкины с образованием ангидрид кислоты или же дикетон товар.[31] Если реакцию проводят в присутствии воды, ангидрид гидролизуется с образованием двух карбоновые кислоты.
Обычно озонолиз проводят в растворе дихлорметан, при температуре −78 ° C. После последовательности расщепления и перегруппировки образуется органический озонид. При восстановительной работе (например, цинк в уксусная кислота или же диметилсульфид ), кетоны и альдегиды будут образовываться в результате окислительной обработки (например, водной или спиртовой пероксид водорода ), будут образовываться карбоновые кислоты.[32]
Другие субстраты
Все три атомы озона может также реагировать, как в реакции хлорид олова (II) с соляная кислота и озон:
Перхлорат йода можно получить путем обработки йод растворяется в холоде безводный хлорная кислота с озоном:
Озон также может реагировать с йодидом калия с образованием кислорода и газообразного йода:
Горение
Озон можно использовать для горение реакции и горючие газы; озон обеспечивает более высокие температуры, чем горение в дикислород (O2). Ниже приводится реакция на горение субнитрид углерода что также может вызвать повышение температуры:
- 3 C
4N
2 + 4 О
3 → 12 СО + 3 N
2
Озон может реагировать при криогенных температурах. При 77 К (-196,2 ° C; -321,1 ° F) атомный водород реагирует с жидким озоном с образованием водорода супероксид радикальный, который димеризуется:[33]
- H + О
3 → HO2 + O - 2 НО2 → ЧАС
2О
4
Восстановление до озонидов
Уменьшение озона дает озонид анион, O−
3. Производные этого аниона взрывоопасны и должны храниться при криогенных температурах. Озонид для всех щелочных металлов известны. КО3, RbO3, и CsO3 могут быть получены из соответствующих супероксидов:
- КО2 + O3 → КО3 + O2
Хотя КО3 может быть сформирован, как указано выше, он также может быть сформирован из гидроксид калия и озон:[34]
- 2 КОН + 5 О3 → 2 КО3 + 5 O2 + H2О
NaO3 и LiO3 должен быть подготовлен действием CsO3 в жидком NH3 на ионообменная смола содержащий Na+ или Ли+ ионы:[35]
- CSO3 + Na+ → Cs+ + NaO3
Решение кальций в аммиаке реагирует с озоном с образованием озонида аммония, а не озонида кальция:[33]
- 3 Ca + 10 NH3 + 6 О
3 → Са · 6NH3 + Са (ОН)2 + Ca (НЕТ3)2 + 2 NH4О3 + 2 O2 + H2
Приложения
Озон можно использовать для удаления утюг и марганец из воды, образуя осадок которые можно фильтровать:
- 2 Fe2+ + O3 + 5 часов2O → 2 Fe (OH)3(s) + O2 + 4 часа+
- 2 Мн2+ + 2 O3 + 4 часа2O → 2 MnO (ОН)2(s) + 2 O2 + 4 часа+
Озон также окисляет растворенные сероводород в воде сернистая кислота:
- 3 О
3 + H2S → H2ТАК3 + 3 O2
Эти три реакции являются центральными при использовании озоновой обработки воды из колодцев.
Озон также выводит токсины цианиды преобразовав их в цианаты.
- CN− + O3 → CNO−
+ O2
Озон также полностью разложится мочевина:[36]
- (NH2)2CO + O3 → N2 + CO2 + 2 часа2О
Спектроскопические свойства
Озон загибается трехатомная молекула с тремя колебательными модами: симметричная растяжка (1103,157 см−1), изгиб (701,42 см−1) и антисимметричной растяжки (1042,096 см−1).[37] Симметричное растяжение и изгиб - слабые поглотители, но антисимметричное растяжение сильное и отвечает за то, что озон является важным второстепенным. парниковый газ. Этот ИК-диапазон также используется для обнаружения окружающего и атмосферного озона, хотя измерения на основе УФ более распространены.[38]
Электронный спектр озона довольно сложен. Обзор можно увидеть в Атласе спектров газообразных молекул, представляющих интерес для атмосферы, MPI Mainz UV / VIS.[39]
Все полосы диссоциативны, что означает, что молекула распадается на О + О2 после поглощения фотона. Наиболее важным поглощением является полоса Хартли, простирающаяся от чуть более 300 нм до чуть более 200 нм. Именно эта полоса отвечает за поглощение ультрафиолета C в стратосфере.
На стороне высоких длин волн полоса Хартли переходит в так называемую полосу Хаггинса, которая быстро спадает, пока не исчезнет на ~ 360 нм. Выше 400 нм, уходя далеко в ближнюю инфракрасную область, находятся полосы Чаппиуса и Вульфа. Там неструктурированные полосы поглощения полезны для обнаружения высоких концентраций озона в окружающей среде, но они настолько слабы, что не имеют большого практического эффекта.
В дальнем УФ-диапазоне наблюдаются дополнительные полосы поглощения, которые медленно увеличиваются от 200 нм до максимума при ~ 120 нм.
Озон в атмосфере Земли
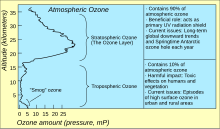


Стандартный способ выразить общий уровень озона (количество озона в заданном вертикальном столбце) в атмосфере - использовать Единицы Добсона. Точечные измерения отображаются как мольные доли в нмоль / моль (частей на миллиард, ppb) или как концентрации в мкг / м3. Изучение концентрации озона в атмосфере началось в 1920-х годах.[40]
Озоновый слой
Расположение и производство
Самый высокий уровень озона в атмосфере находится в стратосфера, в регионе, также известном как озоновый слой от 10 до 50 км над поверхностью (или от 6 до 31 миль). Однако даже в этом «слое» концентрация озона составляет всего от двух до восьми частей на миллион, поэтому большую часть кислорода там составляет двуокись кислорода, O2, примерно 210 000 частей на миллион по объему.[41]
Озон в стратосфере в основном образуется из коротковолновых ультрафиолетовых лучей от 240 до 160 нм. Кислород начинает слабо поглощать при 240 нм в полосах Герцберга, но большая часть кислорода диссоциирует за счет поглощения в сильных Группы Шумана – Рунге между 200 и 160 нм, где озон не поглощает. В то время как более коротковолновый свет, простирающийся даже до предела рентгеновского излучения, достаточно энергичен, чтобы диссоциировать молекулярный кислород, его относительно мало, и сильное солнечное излучение на Лайман-альфа, 121 нм, попадает в точку, где молекулярный кислород абсорбция минимальная.[42]
Процесс создания и разрушения озона называется Цикл Чепмена и начинается с фотолиза молекулярного кислорода
с последующей реакцией атома кислорода с другой молекулой кислорода с образованием озона.
- O + О
2 + M → О
3 + M
где «М» обозначает третье тело, которое уносит избыточную энергию реакции. Затем молекула озона может поглотить фотон УФ-С и диссоциировать.
- О
3 → O + О
2 + кинетическая энергия
Избыточная кинетическая энергия нагревает стратосферу, когда атомы O и молекулярный кислород разлетаются и сталкиваются с другими молекулами. Это преобразование ультрафиолетового света в кинетическую энергию нагревает стратосферу. Атомы кислорода, образующиеся при фотолизе озона, затем вступают в реакцию с другой молекулой кислорода, как на предыдущем этапе, с образованием большего количества озона. В чистой атмосфере, содержащей только азот и кислород, озон может реагировать с атомарным кислородом с образованием двух молекул O2
- О
3 + O → 2 О
2
Оценку скорости этого этапа прекращения круговорота атомарного кислорода обратно в озон можно найти, просто взяв отношения концентраций O2 тоже3. Реакция обрыва есть катализированный наличием определенных свободных радикалов, из которых наиболее важными являются гидроксил (ОН), оксид азота (NO) и атомарный хлор (Cl) и бром (Br). Во второй половине 20 века было обнаружено, что количество озона в стратосфере уменьшается, в основном из-за увеличения концентрации хлорфторуглероды (CFC) и аналогичные хлорированные и бромированные органические молекулы. Обеспокоенность по поводу последствий для здоровья спада привела к 1987 г. Монреальский протокол, запрет на производство многих разрушение озона химические вещества и в первом и втором десятилетии 21 века начало восстановления концентраций стратосферного озона.
Важность жизни на поверхности Земли

Озон в озоновом слое отфильтровывает солнечные лучи с длиной волны от примерно 200 нм до 315 нм, с пиком поглощения озона примерно при 250 нм.[43] Это УФ-поглощение озона важно для жизни, поскольку оно расширяет поглощение УФ-излучения обычным кислородом и азотом в воздухе (которые поглощают все длины волн <200 нм) через нижний УФ-С (200–280 нм) и весь УФ-В. полоса (280–315 нм). Небольшая непоглощенная часть УФ-B, которая остается после прохождения через озон, вызывает солнечный ожог у людей и прямое повреждение ДНК в живых тканях как растений, так и животных. Влияние озона на УФ-В-лучи средней дальности проиллюстрировано его воздействием на УФ-В на длине волны 290 нм, которое имеет интенсивность излучения в 350 миллионов раз мощнее в верхней части атмосферы, чем на поверхности. Тем не менее, достаточное количество УФ-В-излучения аналогичной частоты достигает земли, чтобы вызвать солнечный ожог, и эти же длины волн также являются одними из тех, кто ответственен за производство Витамин Д в людях.
Озоновый слой мало влияет на более длинные волны УФ-излучения, называемые УФ-А (315–400 нм), но это излучение не вызывает солнечных ожогов или прямого повреждения ДНК, и, хотя оно, вероятно, действительно вызывает долговременное повреждение кожи у некоторых людей, оно не так опасен для растений и для здоровья наземных организмов на Земле в целом (см. ультрафиолетовый для получения дополнительной информации о ближнем ультрафиолете).
Озон низкого уровня
Озон низкого уровня (или тропосферный озон) является загрязнителем атмосферы.[44] Он не испускается напрямую автомобильные двигатели или в результате промышленных операций, но образуются в результате реакции солнечного света на воздух, содержащий углеводороды и оксиды азота которые реагируют с образованием озона непосредственно в источнике загрязнения или за много километров по ветру.
Озон напрямую реагирует с некоторыми углеводородами, такими как альдегиды и таким образом начинается их удаление из воздуха, но сами продукты являются ключевыми компонентами смог. Озон фотолиз УФ-светом приводит к образованию гидроксильный радикал HO • и это играет роль в удалении углеводородов из воздуха, но также является первым шагом в создании компонентов смога, таких как пероксиацилнитраты, которые могут быть сильным раздражителем глаз.Время жизни тропосферного озона в атмосфере составляет около 22 дней; его основные механизмы удаления осаждаются на землю, в результате вышеупомянутой реакции с образованием HO •, а также путем реакций с OH и пероксирадикалом HO2•.[45]
Имеются данные о значительном снижении урожайности сельскохозяйственных культур из-за повышения уровня приземного озона и загрязнения, препятствующего фотосинтез и останавливает общий рост некоторых видов растений.[46][47] В Агентство по охране окружающей среды США предлагает вторичное регулирование для уменьшения ущерба урожаю в дополнение к первичному регулированию, предназначенному для защиты здоровья человека.
Озон низкого уровня в городских районах
Некоторые примеры городов с повышенными показателями озона: Денвер, Колорадо, Хьюстон, Техас, и Мехико, Мексика. В Хьюстоне показатель составляет около 41 нмоль / моль, в то время как Мехико гораздо более опасен, с показателем около 125 нмоль / моль.[47]
Озон низкого уровня, или тропосферный озон, представляет собой наиболее опасный вид озонового загрязнения в городских районах, и его масштабы в целом увеличиваются.[48] Загрязнение озоном в городских районах влияет на более плотные слои населения и усугубляется большим количеством транспортных средств, которые выбрасывают загрязняющие вещества NO2 и летучие органические соединения, основные составляющие проблемных уровней озона.[49] Загрязнение озоном в городских районах вызывает особую озабоченность в связи с повышением температуры, увеличивая смертность от жары во время волн жары.[50] Во время волн жары в городских районах загрязнение приземным озоном может быть на 20% выше, чем обычно.[51] Загрязнение озоном в городских районах достигает более высоких уровней летом и осенью, что может быть объяснено погодными условиями и режимами движения.[49] Необходимо провести дополнительные исследования, конкретно касающиеся того, какие группы населения в городских районах больше всего страдают от озона, поскольку цветные люди и люди, живущие в бедности, в большей степени страдают от загрязнения в целом, даже несмотря на то, что эти группы населения с меньшей вероятностью вносят вклад в уровни загрязнения.[52]
Как упоминалось выше, Денвер, штат Колорадо, - один из многих городов США с высоким содержанием озона. По данным Американской ассоциации легких, район Денвер-Аврора занимает 14-е место в США по уровню загрязнения озоном.[53] Проблема высоких уровней озона не нова для этой области. В 2004 году «Агентство по охране окружающей среды США определило район Денверского метро / Северного фронта (Адамс, Арапахо, Боулдер, Брумфилд, Денвер, Дуглас, Джефферсон и некоторые районы округов Лаример и Велд) как недостижимый для 8-часового стандарта озона 1997 года» ,[54] но позже отложил этот статус недостижения до 2007 года. Стандарт недостижения указывает, что территория не соответствует стандартам качества воздуха EPA. План действий по озону штата Колорадо был создан в ответ, и в него были внесены многочисленные изменения. Первым серьезным изменением было то, что испытания на выбросы автомобилей были расширены по всему штату и охватили большее количество округов, которые ранее не требовали проведения испытаний на выбросы, например, области Лаример и округ Уэлд. Также были внесены изменения для уменьшения выбросов оксидов азота (NOx) и летучих органических соединений (ЛОС), что должно помочь снизить уровень озона.
Одним из основных факторов, способствующих повышению уровня озона в этом районе, являются нефть и натуральный газ промышленность, расположенная в бассейне Денвер-Джулесбург (DJB), который перекрывает большинство городских районов Колорадо. Озон создается естественным образом в стратосфере Земли, но также создается в тропосфере в результате усилий человека. Кратко упоминалось выше, NOx и VOC реагируют с солнечным светом с образованием озона посредством процесса, называемого фотохимией. События с повышением содержания озона в течение часа (<75 частей на миллиард) «происходят в течение июня – августа, что указывает на то, что повышенные уровни озона являются следствием региональной фотохимии».[55] Согласно статье из Университета Колорадо в Боулдере, «Выбросы ЛОС из нефти и природного газа играют важную роль в производстве озона и могут способствовать повышению содержания O3 уровни в Северном Колорадском переднем хребте (NCFR) ".[55] Используя комплексный анализ для исследования ветрового режима и выбросов от крупных нефтяных и газовых операций, авторы пришли к выводу, что «повышенное содержание O3 уровни в NCFR в основном коррелируют с воздушным транспортом из N – ESE, которые являются противветренными секторами, где расположены нефтегазовые операции в районе месторождения Ваттенберг в DJB ».[55]
Содержащиеся в Плане действий по озону штата Колорадо, разработанном в 2008 году, существуют планы по оценке «мер контроля выбросов для крупных промышленных источников NOx» и «общегосударственных требований к контролю для новых резервуаров для нефти и газового конденсата и пневматических клапанов».[56] В 2011 году был выпущен Региональный план по борьбе с дымкой, который включал более конкретный план по снижению выбросов NOx. Осуществить эти усилия становится все труднее, и для их реализации потребуются годы. Конечно, есть и другие причины, по которым уровень озона остается высоким. К ним относятся: рост населения, означающий увеличение выбросов автомобилей, и горы вдоль NCFR, которые могут улавливать выбросы. Если интересно, ежедневные показатели качества воздуха можно найти на веб-сайте Министерства здравоохранения и окружающей среды штата Колорадо.[57] Как отмечалось ранее, в Денвере по сей день сохраняется высокий уровень озона. Для борьбы с проблемой высоких уровней озона в Переднем хребте Колорадо потребуется много лет и системный подход.
Растрескивание озона

Озоновый газ атакует любой полимер обладающие олефиновыми или двойные связи внутри своей цепной структуры, например натуральная резина, нитрильный каучук, и стирол-бутадиен резинка. Изделия, изготовленные с использованием этих полимеров, особенно подвержены разрушению, которое со временем приводит к тому, что трещины становятся длиннее и глубже, причем скорость роста трещин зависит от нагрузки, которую несет резиновый компонент, и концентрации озона в атмосфере. Такие материалы можно защитить, добавив антиозонанты, например, воски, которые связываются с поверхностью, образуя защитную пленку, или смешиваются с материалом и обеспечивают долгосрочную защиту. Растрескивание озона когда-то были серьезной проблемой автомобильных шин,[58] например, но с современными шинами это не проблема. С другой стороны, многие важные продукты, такие как прокладки и Уплотнительные кольца, могут подвергаться воздействию озона, образующегося в системах сжатого воздуха. Топливные магистрали изготовленные из армированной резины, также подвержены атакам, особенно в моторном отсеке, где некоторое количество озона вырабатывается электрическими компонентами. Хранение резиновых изделий в непосредственной близости от ОКРУГ КОЛУМБИЯ электрический двигатель может ускорить растрескивание озона. В коммутатор двигателя генерирует искры, которые, в свою очередь, выделяют озон.
Озон как парниковый газ
Хотя озон присутствовал на уровне земли до Индустриальная революция пиковые концентрации в настоящее время намного выше, чем доиндустриальные уровни, и даже фоновые концентрации вдали от источников загрязнения значительно выше.[59][60] Озон действует как парниковый газ, поглощая часть инфракрасный энергия, излучаемая землей. Количественно определить парниковый эффект озона сложно, потому что он не присутствует в однородных концентрациях по всему миру. Однако наиболее широко распространенные научные оценки, касающиеся изменение климата (например, межправительственная комиссия по изменению климата Третий оценочный отчет )[61] предполагаю, что радиационное воздействие тропосферного озона составляет около 25% от углекислый газ.
Ежегодный потенциал глобального потепления тропосферного озона составляет 918–1022 тонн эквивалент двуокиси углерода / т тропосферного озона. Это означает, что в расчете на одну молекулу озон в тропосфере имеет радиационное воздействие эффект примерно в 1000 раз сильнее, чем углекислый газ. Однако тропосферный озон недолговечен. парниковый газ, который распадается в атмосфере гораздо быстрее, чем углекислый газ. Это означает, что за 20-летний период потенциал глобального потепления тропосферного озона намного меньше, примерно от 62 до 69 тонн эквивалент двуокиси углерода на тонну тропосферного озона.[62]
Из-за своего недолговечного характера тропосферный озон не оказывает сильного глобального воздействия, но имеет очень сильное радиационное воздействие в региональном масштабе. На самом деле, есть регионы мира, где тропосферный озон имеет радиационное воздействие до 150% углекислый газ.[63]
Влияние на здоровье
В течение последних нескольких десятилетий ученые изучали влияние острого и хронического воздействия озона на здоровье человека. Сотни исследований показывают, что озон вреден для людей на уровнях, которые в настоящее время наблюдаются в городских районах.[64][65] Было показано, что озон влияет на дыхательную, сердечно-сосудистую и центральную нервную систему. Показано, что ранняя смерть и проблемы репродуктивного здоровья и развития также связаны с воздействием озона.[66]
Уязвимые группы населения
Американская ассоциация легких определила пять групп населения, которые особенно уязвимы к воздействию вдыхания озона:[67]
- Дети и подростки
- Люди 65 лет и старше
- Люди, которые работают или занимаются спортом на открытом воздухе
- Люди с существующими заболеваниями легких, такими как астма и хроническая обструктивная болезнь легких (также известная как ХОБЛ, которая включает эмфизему и хронический бронхит)
- Людям с сердечно-сосудистыми заболеваниями
Дополнительные данные свидетельствуют о том, что женщины, люди с ожирением и люди с низкими доходами также могут сталкиваться с повышенным риском воздействия озона, хотя необходимы дополнительные исследования.[67]
Острое воздействие озона
Острое воздействие озона колеблется от нескольких часов до нескольких дней. Поскольку озон является газом, он напрямую влияет на легкие и всю дыхательную систему. Вдыхаемый озон вызывает воспаление и острые, но обратимые, изменения функции легких, а также гиперчувствительность дыхательных путей.[68] Эти изменения приводят к одышке, свистящему дыханию и кашлю, которые могут обострить заболевания легких, такие как астма или хроническая обструктивная болезнь легких (ХОБЛ), что приводит к необходимости лечения.[69][70] Было доказано, что острое и хроническое воздействие озона вызывает повышенный риск респираторных инфекций в связи со следующим механизмом.[71]
Были проведены многочисленные исследования для определения механизма вредного воздействия озона, особенно на легкие. Эти исследования показали, что воздействие озона вызывает изменения иммунного ответа в легочной ткани, что приводит к нарушению как врожденного, так и адаптивного иммунного ответа, а также к изменению защитной функции эпителиальных клеток легких.[72] Считается, что эти изменения иммунного ответа и связанная с ним воспалительная реакция являются факторами, которые, вероятно, способствуют повышенному риску инфекций легких, а также ухудшению или запуску астмы и реактивных дыхательных путей после воздействия загрязнения озоном на уровне земли.[72][73]
Врожденная (клеточная) иммунная система состоит из различных химических сигналов и типов клеток, которые действуют широко и против нескольких типов патогенов, обычно бактерий или инородных тел / веществ в организме хозяина.[73][74] К клеткам врожденной системы относятся фагоциты, нейтрофилы,[74] Считалось, что оба они вносят свой вклад в механизм озоновой патологии в легких, поскольку было показано, что функционирование этих типов клеток изменяется после воздействия озона.[73] Макрофаги, клетки, которые служат для устранения патогенных микроорганизмов или чужеродных материалов в процессе «фагоцитоза»,[74] было показано, что они изменяют уровень воспалительных сигналов, которые они выделяют в ответ на озон, либо активируя и приводя к воспалительной реакции в легких, либо подавляя и снижая иммунную защиту.[72] Нейтрофилы, еще один важный тип клеток врожденной иммунной системы, который в первую очередь нацелен на бактериальные патогены,[74] обнаруживаются в дыхательных путях в течение 6 часов после воздействия высоких уровней озона. Однако, несмотря на высокие уровни в тканях легких, их способность уничтожать бактерии, по-видимому, ухудшается из-за воздействия озона.[72]
Адаптивная иммунная система - это ветвь иммунитета, которая обеспечивает долгосрочную защиту за счет выработки антител, нацеленных на определенные патогены, а также подвержена сильному воздействию озона.[73][74] Лимфоциты, клеточный компонент адаптивного иммунного ответа, после воздействия озона вырабатывают повышенное количество воспалительных химических веществ, называемых «цитокинами», которые могут способствовать гиперреактивности дыхательных путей и ухудшению симптомов астмы.[72]
Эпителиальные клетки дыхательных путей также играют важную роль в защите людей от патогенов. В нормальной ткани эпителиальный слой образует защитный барьер, а также содержит специализированные ресничные структуры, которые работают для удаления инородных тел, слизи и патогенов из легких. Под воздействием озона реснички повреждаются, и мукоцилиарный клиренс патогенов уменьшается. Кроме того, эпителиальный барьер ослабевает, позволяя патогенам преодолевать барьер, размножаться и распространяться в более глубокие ткани. Вместе эти изменения эпителиального барьера помогают сделать людей более восприимчивыми к легочным инфекциям.[72]
Вдыхание озона влияет не только на иммунную систему и легкие, но также может повлиять на сердце. Озон вызывает кратковременный вегетативный дисбаланс, приводящий к изменениям частоты сердечных сокращений и снижению вариабельности сердечного ритма;[75] и воздействие высоких уровней в течение всего одного часа приводит к наджелудочковой аритмии у пожилых людей,[76] оба повышают риск преждевременной смерти и инсульта. Озон также может вызывать сужение сосудов, что приводит к повышению системного артериального давления, что способствует повышению риска сердечных заболеваний и смертности у пациентов с уже существующими сердечными заболеваниями.[77][78]
Хроническое воздействие озона
Вдыхание озона в течение периодов более восьми часов в течение недель, месяцев или лет определяет хроническое воздействие. Многочисленные исследования указывают на серьезное влияние этого воздействия на здоровье различных групп населения.
Одно исследование обнаруживает значительную положительную связь между хроническим озоном и смертностью от всех причин, кровообращения и респираторных заболеваний с увеличением риска на 2%, 3% и 12% на 10 частей на миллиард.[79] и сообщить о связи (95% ДИ) годовой смертности от озона и всех причин с коэффициентом риска 1,02 (1,01–1,04) и смертностью от сердечно-сосудистых заболеваний 1,03 (1,01–1,05). Подобное исследование обнаруживает аналогичные связи со смертностью от всех причин и даже более серьезными последствиями для смертности от сердечно-сосудистых заболеваний.[80] Повышенный риск смерти от респираторных заболеваний связан с длительным хроническим воздействием озона.[81]
Хронический озон пагубно влияет на детей, особенно на детей, страдающих астмой. Риск госпитализации детей с астмой увеличивается при хроническом воздействии озона; Еще большему риску подвергаются дети младшего возраста и дети с низким доходом.[82]
Взрослые, страдающие респираторными заболеваниями (астма,[83] ХОБЛ,[84] рак легких[85]) подвержены более высокому риску смертности и заболеваемости, а пациенты в критическом состоянии имеют повышенный риск развития острого респираторного дистресс-синдрома при хроническом воздействии озона.[86]
Озон, производимый воздухоочистителями
В Калифорнийский совет по воздушным ресурсам есть страница со списком воздухоочистителей (многие с ионизаторы ) соответствует их пределу содержания озона в помещении 0,050 частей на миллион.[87] Из этой статьи:
| Все портативные устройства для очистки воздуха внутри помещений, продаваемые в Калифорнии, должны быть сертифицированы Калифорнийским советом по воздушным ресурсам (CARB). Чтобы получить сертификат, очистители воздуха должны пройти испытания на электробезопасность и выбросы озона, а также соответствовать пределу концентрации выбросов озона 0,050 частей на миллион. Для получения дополнительной информации о правилах посетите регулировка воздушного фильтра. |
Загрязнение воздуха озоном

Прекурсоры озона представляют собой группу загрязняющих веществ, преимущественно выбрасываемых при сгорании ископаемое топливо. Загрязнение приземным озоном (тропосферный озон ) создается у поверхности Земли под действием дневного света УФ лучи на этих предшественниках. Озон на уровне земли в основном происходит из прекурсоров ископаемого топлива, но метан является естественным предшественником, и очень низкий естественный фоновый уровень озона на уровне земли считается безопасным. В этом разделе исследуется влияние сжигания ископаемого топлива на здоровье, которое поднимает приземный уровень озона намного выше фонового уровня.
Существует множество доказательств того, что приземный озон может нанести вред функции легких и раздражать дыхательная система.[44][89] Воздействие озона (и вызывающих его загрязнителей) связано с преждевременным смерть, астма, бронхит, острое сердечно-сосудистое заболевание, и другие сердечно-легочные проблемы.[90][91]
Было показано, что длительное воздействие озона увеличивает риск смерти от респираторное заболевание. Исследование 450 000 человек, проживающих в городах США, показало значительную корреляцию между уровнем озона и респираторными заболеваниями в течение 18-летнего периода наблюдения. Исследование показало, что у людей, живущих в городах с высоким уровнем озона, таких как Хьюстон или Лос-Анджелес, риск смерти от болезней легких повышается более чем на 30%.[92][93]
Рекомендации по качеству воздуха, например, Всемирная организация здоровья, то Агентство по охране окружающей среды США (EPA) и Евросоюз основаны на подробных исследованиях, направленных на определение уровней, которые могут вызвать поддающиеся измерению последствия для здоровья.
По словам ученых из Агентства по охране окружающей среды США, на восприимчивых людей может негативно повлиять уровень озона до 40 нмоль / моль.[91][94][95] В ЕС текущее целевое значение концентрации озона составляет 120 мкг / м3.3 что составляет около 60 нмоль / моль. Эта цель применяется ко всем странам-членам в соответствии с Директивой 2008/50 / EC.[96] Концентрация озона измеряется как максимальное среднесуточное значение из 8-часовых средних значений, и целевой показатель не должен превышаться более 25 календарных дней в году, начиная с января 2010 года. В то время как директива требует в будущем строгого соблюдения нормы 120 мкг / м3 предел (т.е. средняя концентрация озона, которая не должна быть превышена в любой день года), дата для этого требования не установлена, и это рассматривается как долгосрочная цель.[97]
В США Закон о чистом воздухе поручает EPA установить Национальные стандарты качества окружающего воздуха для нескольких загрязнителей, включая приземный озон, и страны, не соблюдающие эти стандарты, должны принимать меры по снижению их уровней. В мае 2008 года по решению суда EPA снизило свой стандарт озона с 80 нмоль / моль до 75 нмоль / моль. Этот шаг вызвал споры, поскольку собственные ученые и консультативный совет Агентства рекомендовали снизить стандарт до 60 нмоль / моль.[91] Многие группы общественного здравоохранения и окружающей среды также поддержали стандарт 60 нмоль / моль,[98] и Всемирная организация здоровья рекомендует 100 мкг / м3 (51 нмоль / моль).[99]
7 января 2010 года Агентство по охране окружающей среды США (EPA) объявило о предлагаемых изменениях в Национальном стандарте качества окружающего воздуха (NAAQS) для загрязнителя озона, основного компонента смога:
... EPA предлагает, чтобы уровень 8-часового первичного стандарта, который был установлен на уровне 0,075 мкмоль / моль в окончательном правиле 2008 г., вместо этого должен быть установлен на более низком уровне в диапазоне от 0,060 до 0,070 мкмоль / моль, чтобы обеспечивают повышенную защиту детей и других рискованно населения против множества О
3 - связанные с этим неблагоприятные последствия для здоровья, которые варьируются от снижения функции легких и усиления респираторных симптомов до серьезных показателей респираторной заболеваемости, включая посещения отделений неотложной помощи и госпитализацию по респираторным причинам и, возможно, сердечно-сосудистые заболевания, а также общую неаварийную и сердечно-легочную смертность. .[100]
26 октября 2015 года EPA опубликовало окончательное правило с датой вступления в силу 28 декабря 2015 года, в котором 8-часовой первичный NAAQS был изменен с 0,075 до 0,070 промилле.[101]
EPA разработало индекс качества воздуха (AQI), чтобы помочь широкой общественности объяснить уровни загрязнения воздуха. В соответствии с действующими стандартами, средние мольные доли озона за восемь часов от 85 до 104 нмоль / моль описаны как «вредные для чувствительных групп», от 105 до 124 нмоль / моль как «вредные для здоровья» и от 125 до 404 нмоль / моль. нмоль / моль как «очень вредно для здоровья».[102]
Озон также может присутствовать в загрязнение воздуха внутри помещений отчасти из-за использования электронного оборудования, например, копировальных аппаратов. Известно также, что существует связь между увеличением количества пыльцы, грибковых спор и озона, вызванным грозами и госпитализацией астма страдающие.[103]
в Викторианская эпоха Согласно одному британскому народному мифу, запах моря вызван озоном. На самом деле характерный «запах моря» вызван диметилсульфид, химическое вещество, производимое фитопланктон. Британцы викторианской эпохи считали полученный запах «бодрящим».[104]
Тепловые волны
Исследование по оценке совместного воздействия озона и тепла во время волн тепла в Европе в 2003 году показало, что они, по-видимому, являются аддитивными.[105]
Физиология
Озон, наряду с реактивными формами кислорода, такими как супероксид, синглетный кислород, пероксид водорода, и гипохлорит ионов, производится белые кровяные клетки и другие биологические системы (например, корни бархатцы ) как средство уничтожения инородных тел. Озон напрямую реагирует с органическими двойными связями. Кроме того, когда озон распадается на двуокись кислорода, он дает кислород. свободные радикалы, которые обладают высокой реактивностью и способны повредить многие Органические молекулы. Более того, считается, что мощные окислительные свойства озона могут быть фактором, способствующим воспаление. Причинно-следственная связь того, как озон создается в организме и что он делает, все еще рассматривается и все еще подлежит различным интерпретациям, поскольку другие химические процессы в организме могут запускать некоторые из тех же реакций. Команда, возглавляемая Полом Вентвортом-младшим из химического факультета Научно-исследовательский институт Скриппса показали доказательства связи катализированного антителами пути окисления воды у человека иммунная реакция к производству озона. В этой системе озон производится путем катализируемого антителами производства триоксидан из воды и продуцируемого нейтрофилами синглетного кислорода.[106]
При вдыхании озон вступает в реакцию с соединениями, выстилающими легкие, с образованием определенных метаболитов холестерина, которые, как считается, способствуют накоплению и патогенезу атеросклеротические бляшки (форма сердечное заболевание ). Было подтверждено, что эти метаболиты встречаются в природе в атеросклеротических артериях человека и относятся к классу секостеринов, называемых атероналы, создано озонолиз двойной связи холестерина с образованием 5,6 секостерин[107] а также вторичный продукт конденсации путем альдолизации.[108]
Предполагается, что озон оказывает неблагоприятное воздействие на рост растений: «... озон снижает общую концентрацию хлорофиллов, каротиноидов и углеводов, а также увеличивает содержание 1-аминоциклопропан-1-карбоновой кислоты (АСС) и производство этилена. На обработанных растениях Пул листьев аскорбата был уменьшен, в то время как перекисное окисление липидов и утечка растворенных веществ были значительно выше, чем в контроле без озона. Данные показали, что озон запускал защитные механизмы против окислительного стресса в цитрусовых ».[109] Исследования, в которых в качестве модели использовались растения перца, показали, что озон снижает урожайность плодов и изменяет их качество.[110][111] Кроме того, также наблюдалось снижение уровня хлорофиллов и антиоксидантной защиты на листьях, а также повышение уровней активных форм кислорода (АФК) и повреждение липидов и белков.[110][111]
Правила техники безопасности
Из-за сильных окислительных свойств озона озон является основным раздражителем, особенно поражающим глаза и дыхательную систему, и может быть опасным даже при низких концентрациях. Канадский центр безопасности и гигиены труда сообщает, что:
Даже очень низкие концентрации озона могут нанести вред верхним дыхательным путям и легким. Тяжесть травмы зависит как от концентрации озона, так и от продолжительности воздействия. Серьезное и необратимое повреждение легких или смерть может произойти даже в результате очень кратковременного воздействия относительно низких концентраций ».[112]
Для защиты рабочих, потенциально подверженных воздействию озона, Администрация США по охране труда установил допустимый предел воздействия (PEL) 0,1 мкмоль / моль (29 CFR 1910.1000, таблица Z-1), рассчитанный как 8-часовое средневзвешенное значение по времени. Более высокие концентрации особенно опасны и NIOSH установил предел немедленной опасности для жизни и здоровья (IDLH) в 5 мкмоль / моль.[113] Рабочие среды, в которых используется озон или где он может образовываться, должны иметь соответствующую вентиляцию, и разумно иметь прибор для измерения озона, который будет сигнализировать, если его концентрация превысит OSHA PEL. Непрерывные мониторы озона доступны от нескольких поставщиков.
Повышенное воздействие озона может произойти на пассажирский самолет, с уровнями в зависимости от высоты и атмосферной турбулентности.[114] Соединенные Штаты Федеральное управление гражданской авиации нормативы устанавливают предел в 250 нмоль / моль с максимальным четырехчасовым средним значением 100 нмоль / моль.[115] Некоторые самолеты оснащены преобразователями озона в системе вентиляции, чтобы уменьшить воздействие на пассажиров.[114]
Производство

Генераторы озона, или же озонаторы,[116] используются для производства озона для очистки воздуха или удаления запаха дыма в пустых помещениях. Эти генераторы озона могут производить более 3 г озона в час. Озон часто образуется в природе в условиях, когда O2 не будет реагировать.[22] Озон, используемый в промышленности, измеряется в мкмоль / моль (ppm, частей на миллион), нмоль / моль (ppb, частей на миллиард), мкг / м3, мг / ч (миллиграммы в час) или массовые проценты. Режим применяемых концентраций составляет от 1% до 5% (в воздухе) и от 6% до 14% (в кислороде) для методов старшего поколения. Новые электролитические методы позволяют достичь концентрации растворенного озона в выходной воде от 20% до 30%.
Температура и влажность играют большую роль в том, сколько озона производится с использованием традиционных методов генерации (таких как коронный разряд и ультрафиолетовый свет). Методы старого поколения будут производить менее 50% номинальной мощности при работе с влажным окружающим воздухом, а не с очень сухим воздухом. Новые генераторы, использующие электролитические методы, могут достичь более высокой чистоты и растворения за счет использования молекул воды в качестве источника производства озона.
Метод коронного разряда

Это наиболее распространенный тип генератора озона для большинства промышленных и личных нужд. Несмотря на то, что существуют разновидности метода получения озона с помощью коронального разряда с горячей искрой, включая генераторы озона медицинского и промышленного назначения, эти устройства обычно работают с помощью трубка коронного разряда или озоновая пластина.[117][118] Как правило, они экономичны и не требуют источника кислорода, кроме окружающего воздуха, для получения озона с концентрацией 3–6%. Колебания в окружающем воздухе из-за погоды или других условий окружающей среды вызывают колебания в производстве озона. Однако они также производят оксиды азота как побочный продукт. Использование осушитель воздуха может уменьшить или исключить образование азотной кислоты за счет удаления водяного пара и увеличения производства озона. При комнатной температуре азотная кислота образует пар, который опасен при вдыхании. Симптомы могут включать боль в груди, одышку, головные боли и сухость в носу и горле, вызывающую чувство жжения. Использование кислородный концентратор может еще больше увеличить производство озона и дополнительно снизить риск образования азотной кислоты за счет удаления не только водяного пара, но и основной части азота.
Ультрафиолетовый свет
УФ-генераторы озона или вакуумно-ультрафиолетовые (ВУФ) генераторы озона используют источник света, который генерирует узкополосный ультрафиолетовый свет, подмножество света, производимого Солнцем.Ультрафиолетовое излучение Солнца поддерживает озоновый слой в стратосфере Земли.[119]
УФ-генераторы озона используют окружающий воздух для производства озона, не используются системы подготовки воздуха (осушитель воздуха или концентратор кислорода), поэтому эти генераторы, как правило, дешевле. Однако УФ-генераторы озона обычно производят озон с концентрацией около 0,5% или ниже, что ограничивает потенциальную скорость образования озона. Другой недостаток этого метода заключается в том, что он требует, чтобы окружающий воздух (кислород) подвергался воздействию УФ-источника в течение более длительного периода времени, и любой газ, который не подвергается воздействию УФ-источника, не будет обрабатываться. Это делает УФ-генераторы непрактичными для использования в ситуациях, связанных с быстро движущимися воздушными или водяными потоками (воздух в воздуховоде стерилизация, Например). Производство озона - одно из потенциальные опасности из бактерицидное ультрафиолетовое облучение. Генераторы озона VUV используются в плавательных бассейнах и спа применения до миллионов галлонов воды. Генераторы озона VUV, в отличие от генераторов коронного разряда, не производят вредных побочных продуктов азота, а также, в отличие от систем коронного разряда, генераторы озона VUV очень хорошо работают во влажной воздушной среде. Также обычно нет необходимости в дорогостоящих механизмах для отвода отходящих газов и в осушителях воздуха или концентраторах кислорода, которые требуют дополнительных затрат и технического обслуживания.
Холодная плазма
В методе холодной плазмы чистый газообразный кислород подвергается воздействию плазма сделано диэлектрический барьерный разряд. Двухатомный кислород расщепляется на отдельные атомы, которые затем рекомбинируют в триплеты с образованием озона.
Установки холодной плазмы используют чистый кислород в качестве входного источника и производят озон с максимальной концентрацией около 5%. Они производят гораздо большее количество озона за определенный промежуток времени по сравнению с производством ультрафиолета. Однако, поскольку генераторы озона холодной плазмы очень дороги, они встречаются реже, чем два предыдущих типа.
Разряды проявляются как нитевидный перенос электронов (микроразряды) в зазоре между двумя электродами. Для равномерного распределения микроразрядов диэлектрик изолятор должны использоваться для разделения металлических электродов и предотвращения искрения.
Некоторые установки холодной плазмы также способны производить короткоживущие аллотропы кислорода, которые включают O4, O5, O6, O7и т. д. Эти виды даже более реактивны, чем обычные О
3.[120]
Электролитический
Генерация электролитического озона (EOG) расщепляет молекулы воды на H2, O2, а O3.В большинстве методов EOG газообразный водород удаляется, чтобы кислород и озон оставались единственными продуктами реакции. Следовательно, EOG может достичь более высокого растворение в воде без других конкурирующих газов, присутствующих в методе коронного разряда, таких как газообразный азот, присутствующий в окружающем воздухе. Этот метод генерации позволяет достичь концентраций 20–30% и не зависит от качества воздуха, поскольку в качестве исходного материала используется вода. Электролитическое получение озона обычно неблагоприятно из-за высокой перенапряжение требуется для производства озона по сравнению с кислородом. Вот почему во время обычного электролиза воды не образуется озон. Однако можно увеличить перенапряжение кислорода путем тщательного выбора катализатора, так что озон предпочтительно образуется при электролизе. Катализаторы, обычно выбираемые для этого подхода: диоксид свинца[121] или алмаз, легированный бором.[122]
Отношение озона к кислороду улучшается за счет увеличения плотности тока на аноде, охлаждения электролита вокруг анода до значения, близкого к 0 ° C, использования кислотного электролита (такого как разбавленная серная кислота) вместо основного раствора и применения вместо него импульсного тока. DC.[123]
Особые соображения
Озон нельзя хранить и транспортировать, как другие промышленные газы (потому что он быстро разлагается на двухатомный кислород), и поэтому он должен производиться на месте. Доступные генераторы озона различаются по расположению и конструкции высоковольтных электродов. При производственных мощностях более 20 кг в час трубчатый теплообменник газ / вода может использоваться в качестве заземляющего электрода и собираться с трубчатыми высоковольтными электродами со стороны газа. Режим типичных давлений газа составляет около 2 бары (200 кПа ) абсолютное значение в кислороде и 3 бара (300 кПа) в воздухе. Несколько мегаватт электричество может быть установлен на крупных объектах, применяется как однофазный переменный ток Текущий при 50-8000 Гц и пике напряжения от 3000 до 20 000 вольт. Приложенное напряжение обычно обратно пропорционально приложенной частоте.
Доминирующим параметром, влияющим на эффективность генерации озона, является температура газа, которая регулируется температурой охлаждающей воды и / или скоростью газа. Чем прохладнее вода, тем лучше синтез озона. Чем ниже скорость газа, тем выше его концентрация (но тем меньше чистый озон). В типичных промышленных условиях почти 90% эффективной мощности рассеивается в виде тепла и требует отвода достаточного потока охлаждающей воды.
Из-за высокой реакционной способности озона можно использовать только несколько материалов, например нержавеющая сталь (качество 316L), титан, алюминий (при отсутствии влаги), стекло, политетрафторэтилен, или же поливинилиденфторид. Витон может использоваться при ограничении постоянных механических сил и отсутствии влажности (ограничения по влажности применяются в зависимости от рецептуры). Hypalon может использоваться с ограничением, что вода не контактирует с ним, за исключением нормального атмосферного уровня. Охрупчивание или усадка - это обычная причина разрушения эластомеров под воздействием озона. Озоновое растрескивание - это обычная причина выхода из строя эластомерных уплотнений, таких как Уплотнительные кольца.
Силиконовые каучуки обычно подходят для использования в качестве прокладки при концентрациях озона ниже 1 мас.%, например, в оборудовании для ускоренного старения образцов резины.
Случайное производство
Озон может образовываться из О
2 электрическими разрядами и действием высокой энергии электромагнитное излучение. Неподавленная дуга в электрических контактах, щетках двигателя или механических переключателях разрушает химические связи атмосферного кислорода, окружающего контакты [О
2 → 2O]. Свободные радикалы кислорода внутри дуги и вокруг нее рекомбинируют с образованием озона [О
3].[124] Определенный электрическое оборудование генерируют значительные уровни озона. Особенно это касается устройств, использующих высокое напряжение, Такие как ионные очистители воздуха, лазерные принтеры, копировальные аппараты, электрошокеры и дугосварщики. Электродвигатели с помощью кисти может генерировать озон из повторяющихся искрение внутри устройства. Большие двигатели, в которых используются щетки, такие как используемые в лифтах или гидравлических насосах, будут генерировать больше озона, чем двигатели меньшего размера.
Озон также образуется в Кататумбо грозы явление на Река Кататумбо в Венесуэла, хотя нестабильность озона делает сомнительным его влияние на озоносферу.[125]Это крупнейший в мире природный генератор озона, поэтому его называют Объект всемирного наследия ЮНЕСКО.[126]
Лабораторное производство

В лаборатории озон может производиться электролиз используя Батарея 9 вольт, карандаш графитовый стержень катод, а платина провод анод и 3 коренной зуб серная кислота электролит.[127] В половина клетки имеют место следующие реакции:
- 3 ч2О → О3 + 6 часов+ + 6 e− (ΔE° = −1.53 V )
- 6 часов+ + 6 e− → 3 H2 (ΔE° = 0 В)
- 2 ч2О → О2 + 4 часа+ + 4 е− (ΔE° = 1,23 В)
В чистой реакции три эквивалента воды превращаются в один эквивалент озона и три эквивалента водород. Образование кислорода - это конкурирующая реакция.
Он также может быть сгенерирован высокое напряжение дуга. В своей простейшей форме высоковольтный переменный ток, такой как выход неоновая вывеска трансформатор соединен с двумя металлическими стержнями, концы которых расположены достаточно близко друг к другу, чтобы образовалась дуга. Возникающая дуга преобразует кислород воздуха в озон.
Часто желательно содержать озон. Это можно сделать с помощью устройства, состоящего из двух концентрических стеклянных трубок, соединенных вместе вверху, с отверстиями для газа вверху и внизу внешней трубы. Внутренний сердечник должен иметь кусок металлической фольги, вставленный в него, подключенный к одной стороне источника питания. Другая сторона источника питания должна быть подключена к другому куску фольги, обернутому вокруг внешней трубки. Источник сухого О
2 применяется к нижнему порту. Когда на фольговые выводы подается высокое напряжение, электричество разрядится между сухим кислородом посередине и образует О
3 и О
2 который вытечет из верхнего порта. Это называется озонатором Симена. Реакцию можно резюмировать следующим образом:[22]
Приложения
Промышленность
В наибольшей степени озон используется при приготовлении фармацевтические препараты, синтетические смазки, и многие другие коммерчески полезные органические соединения, где он используется для разделения углерод -углеродные облигации.[22] Его также можно использовать для отбеливание веществ и для уничтожения микроорганизмов в воздухе и источниках воды.[128] Многие муниципальные системы питьевой воды убивают бактерии с помощью озона вместо более распространенных хлор.[129] Озон имеет очень высокий окислительный потенциал.[130] Озон не образует хлорорганические соединения соединений и не остается в воде после обработки. Озон может образовывать предполагаемый канцероген бромат в исходной воде с высоким бромид концентрации. Соединенные штаты. Закон о безопасной питьевой воде требует, чтобы эти системы вводили количество хлора для поддержания минимального остаточного содержания 0,2 мкмоль / моль. свободный хлор в трубах по результатам регулярных испытаний. Где электричество В изобилии озон является экономически эффективным методом очистки воды, поскольку он производится по запросу и не требует транспортировки и хранения опасных химических веществ. После разложения питьевая вода не оставляет ни вкуса, ни запаха.
Хотя низкие уровни озона рекламируются как дезинфицирующие средства в жилых домах, концентрация озона в сухом воздухе, необходимая для быстрого и существенного воздействия на переносимые по воздуху патогены, превышает безопасные уровни, рекомендованные США. Управление по охране труда и Агентство по охране окружающей среды. Контроль влажности может значительно улучшить как убивающую способность озона, так и скорость, с которой он снова превращается в кислород (чем больше влажность, тем выше эффективность). Споры формы большинства патогенов очень устойчивы к атмосферному озону в концентрациях, при которых у больных астмой возникают проблемы.
В промышленности озон используется для:
- Продезинфицируйте белье в больницах, на пищевых фабриках, домах престарелых и т. Д .;[131]
- Дезинфицируйте воду вместо хлора[22]
- Дезодорировать воздух и предметы, например, после пожара. Этот процесс широко используется в восстановление ткани
- Убивать бактерии на пище или контактирующих поверхностях;[132]
- Водоемкие отрасли, такие как пивоварни и молочный растения могут эффективно использовать растворенный озон в качестве замены химических дезинфицирующих средств, таких как перуксусная кислота, гипохлорит или тепло.
- Дезинфицировать градирни и контроль легионелла с уменьшенным расходом химикатов, отводом воды и повышенной производительностью.
- Дезинфицируйте бассейны и спа
- Убейте насекомых в хранящемся зерне[133]
- Очистите воздух от спор дрожжей и плесени на предприятиях пищевой промышленности;
- Мойте свежие фрукты и овощи, чтобы убить дрожжи, плесень и бактерии;[132]
- Химически воздействовать на загрязняющие вещества в воде (утюг, мышьяк, сероводород, нитриты, и сложная органика, объединенная как «цвет»);
- Оказывать помощь флокуляция (агломерация молекул, которая помогает в фильтрации, где железо и мышьяк удаляются);
- Производство химических соединений путем химического синтеза[134]
- Очистить и отбелить ткани[нужна цитата ] (первое применение используется при реставрации тканей, второе - запатентовано);[135]
- Действовать как антихлор при отбеливании на основе хлора;
- Оказывать помощь в обработке пластмасс для обеспечения адгезии чернил;
- Возраст образцов резины для определения срока службы партии резины;
- Искоренить паразитов, передающихся через воду, таких как Лямблии лямблии и Криптоспоридиум в очистных сооружениях поверхностных вод.
Озон - это реагент во многих органические реакции в лаборатории и на производстве. Озонолиз это расщепление алкен к карбонил соединения.
Многие больницы по всему миру используют большие генераторы озона для обеззараживания операционных между операциями. Помещения убираются, а затем герметично закрываются перед заполнением озоном, который эффективно убивает или нейтрализует все оставшиеся бактерии.[136]
Озон используется как альтернатива хлор или же диоксид хлора в отбеливание древесной массы.[137] Его часто используют в сочетании с кислородом и перекисью водорода, чтобы исключить потребность в хлорсодержащих соединениях при производстве высококачественных белых бумага.[138]
Озон можно использовать для детоксикации цианид отходы (например, от золото и серебро добыча полезных ископаемых ) путем окисления цианида до цианат и в конечном итоге углекислый газ.[139]
Обеззараживание воды
С момента изобретения Диэлектрический барьерный разряд (DBD) плазменные реакторы, он использовался для обработки воды озоном.[140] Однако с более дешевыми альтернативными дезинфицирующими средствами, такими как хлор, такие применения обеззараживания воды озоном DBD были ограничены высоким потреблением энергии и громоздким оборудованием.[141][142] Несмотря на это, благодаря исследованиям, показывающим отрицательное влияние обычных дезинфицирующих средств, таких как хлор, на токсичные остатки и неэффективность в уничтожении определенных микроорганизмов,[143] Обеззараживание озоном с помощью плазменного DBD представляет интерес в современных доступных технологиях. Хотя озонирование воды с высокой концентрацией бромида действительно приводит к образованию нежелательных бромированных побочных продуктов дезинфекции, если питьевая вода не производится путем опреснения, озонирование, как правило, может применяться без учета этих побочных продуктов.[142][144][145][146] Преимущества озона включают высокий термодинамический окислительный потенциал, меньшую чувствительность к органическим материалам и лучшую устойчивость к колебаниям pH при сохранении способности убивать бактерии, грибки, вирусы, а также споры и цисты.[147][148][149] Хотя озон был широко распространен в Европе на протяжении десятилетий, он редко используется для дезактивации в США из-за ограничений, связанных с высоким энергопотреблением, громоздкостью установки и позором, связанным с токсичностью озона.[141][150] Учитывая это, недавние исследовательские усилия были направлены на изучение эффективных систем очистки воды озоном. [151] Исследователи изучили легкие и компактные поверхностные реакторы DBD малой мощности.[152][153] энергоэффективные объемные реакторы DBD[154] и маломощные реакторы DBD микромасштаба.[155][156] Такие исследования могут помочь проложить путь к повторному принятию технологии обеззараживания воды озоном с помощью плазменного DBD, особенно в США.
Потребители
Устройства, вырабатывающие высокий уровень озона, некоторые из которых используют ионизацию, используются для дезинфекции и дезодорации нежилых зданий, комнат, воздуховодов, дров, лодок и других транспортных средств.
В США., очистители воздуха с низким уровнем озона были проданы. Иногда утверждают, что этот вид очистителя воздуха имитирует естественный способ очистки воздуха без фильтров и дезинфицирует как его, так и бытовые поверхности. В Агентство по охране окружающей среды США (EPA) заявило, что есть «доказательства того, что в концентрациях, не превышающих стандарты общественного здравоохранения, озон неэффективен для удаления многих вызывающих запах химикатов» или «вирусов, бактерий, плесени или других биологических загрязнителей». Кроме того, в его отчете говорится, что «результаты некоторых контролируемых исследований показывают, что концентрации озона, значительно превышающие эти стандарты [безопасности человека], возможны, даже когда пользователь следует инструкциям производителя по эксплуатации».[157]
Озонированная вода используется для стирки одежды и дезинфекции продуктов питания, питьевой воды и поверхностей в доме. Согласно Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), это «вносит поправки в пищевая добавка правила, обеспечивающие безопасное использование озона в газовой и водной фазах в качестве противомикробный агент пищевых продуктов, включая мясо и птицу ». Калифорнийский политехнический университет продемонстрировали, что уровень озона, растворенного в фильтрованной водопроводной воде 0,3 мкмоль / моль, может привести к сокращению более чем на 99,99% таких пищевых микроорганизмов, как сальмонелла, Кишечная палочка 0157: H7 и Campylobacter. Это количество в 20 000 раз больше ВОЗ -рекомендуемые пределы указаны выше.[132][158]Озон можно использовать для удаления пестицид остатки от фрукты и овощи.[159][160]
Озон используется в домах и джакузи для уничтожения бактерий в воде и уменьшения количества хлора или брома, необходимого для их реактивации до их свободного состояния. Поскольку озон не остается в воде достаточно долго, сам по себе озон неэффективен для предотвращения перекрестного загрязнения купающихся и должен использоваться вместе с галогены. Газообразный озон, созданный ультрафиолетовым светом или коронным разрядом, вводится в воду.[161]
Озон также широко используется для обработки воды в аквариумах и прудах. Его использование может минимизировать рост бактерий, контролировать паразитов, исключить передачу некоторых заболеваний и уменьшить или устранить «пожелтение» воды. Озон не должен контактировать с жаберными структурами рыб. Природная соленая вода (с формами жизни) обеспечивает достаточную «мгновенную потребность», чтобы контролируемое количество озона активировало ионы бромида, чтобы гипобромистая кислота, и озон полностью распадается от нескольких секунд до минут. Если используется озон, подаваемый кислородом, в воде будет больше растворенного кислорода, и структуры жабр рыб атрофируются, что делает их зависимыми от воды, обогащенной кислородом.
Аквакультура
Озонирование - процесс насыщения воды озоном - можно использовать в аквакультуре для облегчения разложения органических веществ. Озон также добавляется в рециркуляционные системы, чтобы уменьшить нитрит уровни[162] через преобразование в нитрат. Если уровень нитритов в воде высок, нитриты также будут накапливаться в крови и тканях рыб, где они мешают транспорту кислорода (вызывают окисление гемовой группы гемоглобин из черных металлов (Fe2+
) на железо (Fe3+
), что делает гемоглобин неспособным связывать О
2).[163] Несмотря на эти очевидные положительные эффекты, использование озона в системах рециркуляции было связано со снижением уровня биодоступного йода в системах с соленой водой, что привело к появлению таких симптомов дефицита йода, как зоб и снижение роста сенегальской подошвы (Solea senegalensis ) личинки.[164]
Морская озонатная вода используется для дезинфекции поверхностей пикша и Атлантический палтус яйца против нодавируса. Нодавирус - это смертельный вирус, передающийся вертикально, вызывающий серьезную смертность рыб. Яйца пикши не следует обрабатывать высоким содержанием озона, поскольку обработанные таким образом яйца не вылупляются и погибают через 3–4 дня.[165]
сельское хозяйство
Обработка озоном свежесрезанных ананасов и бананов показывает увеличение содержания флавоноидов и общего фенола при воздействии до 20 минут. Снижение аскорбиновая кислота (одна форма Витамин С ), но положительное влияние на общее содержание фенола и флавоноидов может преодолеть отрицательный эффект.[166] Помидоры после обработки озоном показывают увеличение β-каротина, лютеина и ликопина.[167] Однако нанесение озона на клубнику в предуборочный период показывает снижение содержания аскорбиновой кислоты.[168]
Озон способствует извлечению некоторых тяжелых металлов из почвы с помощью EDTA. ЭДТА образует сильные водорастворимые координационные соединения с некоторыми тяжелыми металлами (Pb, Zn ), что позволяет вывести их из загрязненной почвы. Если загрязненная почва предварительно обработана озоном, эффективность извлечения Pb, Являюсь и Пу увеличивается на 11,0–28,9%,[169] 43.5%[170] и 50,7%[170] соответственно.
Альтернативная медицина
Использование озона для лечения заболеваний не подтверждено доказательствами высокого качества и обычно считается Альтернативная медицина.[171]
Смотрите также
- Циклический озон
- Глобальный мониторинг озона по покрытию звезд (ГОМОС)
- Глобальное потепление
- Парниковый газ
- Поглощение Chappuis
- Международный день охраны озонового слоя (16 сентября)
- Оксиды азота
- День действия озона
- Истощение озонового слоя, включая явление, известное как озоновая дыра.
- Озонотерапия
- Озоневеб
- Озонолиз
- Деградация полимера
- Стерилизация (микробиология)
Примечания
- ^ Это давление пара предназначено для критическая температура, что ниже комнатная температура.
Рекомендации
- ^ а б c d е Карманный справочник NIOSH по химической опасности. "#0476". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Газовая энциклопедия; Озон
- ^ Катбертсон, Клайв; Катбертсон, Мод (1914). «О преломлении и дисперсии галогенов, галогеновых кислот, озона, паровых оксидов азота и аммиака». Философские труды Королевского общества A. 213 (497–508): 1–26. Bibcode:1914РСПТА.213 .... 1С. Дои:10.1098 / рста.1914.0001. Получено 4 февраля 2016.
- ^ «Озон». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Штренг, А. Г. (1961). «Таблицы свойств озона». Журнал химических и технических данных. 6 (3): 431–436. Дои:10.1021 / je00103a031.
- ^ а б Тот, Гэри; Хиллгер, Дон. "Вкладчики в метеорологию эпохи предшественников". colostate.edu.
- ^ а б Рубин, Мордехай Б. (2001). "История озона: период Шенбейна, 1839–1868 гг." (PDF). Бык. Hist. Chem. 26 (1): 40–56. Архивировано из оригинал (PDF) на 2008-04-11. Получено 2008-02-28.
- ^ «Ученые, родившиеся 18 октября». Сегодня в истории науки.
- ^ а б c d Яцевич, Натали (2017). "Убийца лекарства". Дистилляции. 3 (1): 34–37. Получено 13 апреля, 2018.
- ^ Ле Престре, Филипп Г., изд. (1998). Защита озонового слоя: уроки, модели и перспективы; [результат коллоквиума, посвященного десятой годовщине Монреальского протокола, состоявшегося 13 сентября 1997 г .; часть серии мероприятий, проведенных в Монреале по случаю десятой годовщины подписания Монреальского протокола по веществам, разрушающим озоновый слой, 16 сентября 1987 г.]. Бостон: Клувер. п. 2. ISBN 9780792382454.
- ^ Шенбейн, Кристиан Фридрих (1840). «Исследование природы запаха в некоторых химических реакциях». Письмо в Академию наук в Париже.
- ^ Жак-Луи Соре (1865). "Recherches sur la densité de l'ozone". Comptes rendus de l'Académie des Sciences. 61: 941.
- ^ "Озон FAQ". Главный каталог глобальных изменений. Архивировано из оригинал на 2006-06-01. Получено 2006-05-10.
- ^ Собрание Торговой палаты Редлендса, Городской архив, А.К. Публичная библиотека Смайли, Редлендс, Калифорния
- ^ Генри Хеншоу - Уильяму Брюстеру, 2 июля 1902 г., Гарвардский музей сравнительной зоологии.
- ^ О'Коннелл, Санджида (18 августа 2009 г.). "Наука, стоящая за этим свежим морским запахом". Телеграф.
- ^ Ансти, Фрэнсис (1874). «Клиника месяца: доктор МакКендрик об озоне». Практик: Журнал терапии и общественного здравоохранения. 12 (Январь – июнь): 123.
- ^ Рубин, Мордехай Б. (2001). "ИСТОРИЯ ОЗОНА. ШОНБЕЙНСКИЙ ПЕРИОД, 1839–1868 гг." (PDF). Вестник истории химии. 26 (1): 48. Получено 13 апреля 2018.
- ^ Hill, L .; Флэк, М. (28 декабря 1911 г.). «Физиологическое влияние озона». Труды Королевского общества B: биологические науки. 84 (573): 404–415. Bibcode:1911RSPSB..84..404H. Дои:10.1098 / rspb.1911.0086.
- ^ Стокер, Джордж (1916). «Хирургическое использование озона». Ланцет. 188 (4860): 712. Дои:10.1016 / S0140-6736 (01) 31717-8.
- ^ «Кислород». WebElements. Получено 2006-09-23.
- ^ а б c d е Браун, Теодор Л .; LeMay, H. Eugene, Jr .; Bursten, Bruce E .; Бердж, Джулия Р. (2003) [1977]. «22». В Николь Фолчетти (ред.). Химия: центральная наука (9-е изд.). Pearson Education. С. 882–883. ISBN 978-0-13-066997-1.
- ^ Танака, Такехико; Морино, Йонезо (1970). «Кориолисово взаимодействие и ангармоническая потенциальная функция озона из микроволновых спектров в возбужденных колебательных состояниях». Журнал молекулярной спектроскопии. 33 (3): 538–551. Bibcode:1970JMoSp..33..538T. Дои:10.1016/0022-2852(70)90148-7.
- ^ Мак, Кеннет М .; Мюнтер, Дж. С. (1977). «Штарк и Зееман свойства озона по молекулярно-лучевой спектроскопии». Журнал химической физики. 66 (12): 5278–5283. Bibcode:1977ЖЧФ..66.5278М. Дои:10.1063/1.433909.
- ^ Время полураспада озона в зависимости от условий воздуха и движения McClurkin, J.D. * # 1, Maier, D.E.2. Дои:10.5073 / jka.2010.425.167.326
- ^ Утвержденный американский национальный стандарт ANSI. «Вентиляция и приемлемое качество воздуха в малоэтажных жилых домах» (PDF). Американское общество инженеров по отоплению, охлаждению и кондиционированию воздуха. ASHRAE. Получено 2 апреля 2020.
- ^ - Часто задаваемые вопросы по наукам о Земле: где я могу найти информацию об озоновой дыре и истощении озонового слоя? В архиве 2006-06-01 на Wayback Machine Центр космических полетов Годдарда, Национальное управление по аэронавтике и исследованию космического пространства, март 2008 г.
- ^ Койке, К; Нифуку, М; Идзуми, К; Накамура, S; Fujiwara, S; Хоригучи, S (2005). «Взрывоопасные свойства высококонцентрированного газа озона» (PDF). Журнал предотвращения потерь в обрабатывающих отраслях. 18 (4–6): 465. Дои:10.1016 / j.jlp.2005.07.020. Архивировано из оригинал (PDF) 27 марта 2009 г.
- ^ «Электрохимическое производство озоновой воды высокой концентрации с использованием отдельно стоящих перфорированных алмазных электродов».
- ^ Харрис, Дэниел С. (2007). Количественный химический анализ. В. Х. Фриман. стр.279. ISBN 9780716776949.
- ^ Бейли, П. С. (1982). "Глава 2". Озонирование в органической химии. 2. Нью-Йорк, Нью-Йорк: Academic Press. ISBN 978-0-12-073102-2.
- ^ Соломонс, Т. Грэм и Фрайл, Крейг Б. (2008). «Глава 8 Алкены и алкины - Часть II: Реакции присоединения и синтез». Органическая химия, 9-е издание. Вайли. п. 344. ISBN 978-0-470-16982-7.
- ^ а б Horvath M .; Билицкий Л .; Хаттнер Дж. (1985). Озон. Эльзевир. С. 44–49. ISBN 978-0-444-99625-1.
- ^ Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. п. 439. ISBN 978-0-13-039913-7.
- ^ Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. п. 265. ISBN 978-0-13-039913-7.
- ^ Horvath M .; Билицкий Л .; Хаттнер Дж. (1985). Озон. Эльзевир. С. 259, 269–270. ISBN 978-0-444-99625-1.
- ^ Шиманоути, Т. (1972). «Озон». NIST: Национальный институт стандартов и технологий. Министерство торговли США. 6 (3): 993–1102.
- ^ Всемирная метеорологическая организация. «Глава 16: Измерение озона» (PDF). Часть I: Измерение метеорологических переменных. Архивировано из оригинал (PDF) 31 марта 2016 г.
- ^ Институт Макса Планка - Майнц. "Атлас спектров газообразных молекул, представляющих интерес для атмосферы, MPI-Mainz UV / VIS".
- ^ «Измеренное разрушение озонового слоя». Ozone-Information.com. Архивировано из оригинал на 2013-09-14. Получено 2014-01-22.
- ^ Халтман, Г. Эрик (1980-01-01). Руководство по выживанию в озоне. Макгроу-Хилл. ISBN 9780915498734.
- ^ Келлер-Рудек, Ханнелора. "Атлас спектра газообразных молекул, представляющих интерес для атмосферы: O2, Lyman-alpha", MPI-Mainz UV / VIS ". Архивировано из оригинал на 2015-11-17.
- ^ Мацуми, Ютака; Кавасаки, Масахиро (2003). «Фотолиз атмосферного озона в ультрафиолетовой области». Химические обзоры. 103 (12): 4767–82. Дои:10.1021 / cr0205255. PMID 14664632. Посмотрите на графическое изображение поглощения озона в двух его полосах поглощения в зависимости от длины волны.
- ^ а б Аспекты загрязнения воздуха твердыми частицами, озоном и диоксидом азота для здоровья. Отчет ВОЗ-Европа 13–15 января 2003 г. (PDF)
- ^ Стивенсон; и другие. (2006). «Многомодельное ансамблевое моделирование тропосферного озона в настоящем и ближайшем будущем». Американский геофизический союз. Получено 2006-09-16.
- ^ «Повышение уровня озона создает проблемы для производства сои в США, - говорят ученые». Земная обсерватория НАСА. 2003-07-31. Получено 2006-05-10.
- ^ а б Mutters, Рэндалл (март 1999). «Потенциальная потеря урожайности в масштабе штата в результате воздействия озона». Калифорнийский совет по воздушным ресурсам. Архивировано из оригинал на 2004-02-17. Получено 2006-05-10.
- ^ Переосмысление проблемы озона в загрязнении воздуха в городах и регионах. 1991-01-01. Дои:10.17226/1889. ISBN 978-0-309-04631-2.
- ^ а б Шарма, Сумит; Шарма, Пратик; Кхаре, Мукеш; Кватра, Свати (май 2016 г.). «Статистическое поведение озона в городской среде». Устойчивое исследование окружающей среды. 26 (3): 142–148. Дои:10.1016 / j.serj.2016.04.006.
- ^ Diem, Jeremy E .; Stauber, Christine E .; Ротенберг, Ричард (2017-05-16). Аньель, Хуан А. (ред.). «Жара на юго-востоке США: характеристики, тенденции и потенциальное воздействие на здоровье». PLOS ONE. 12 (5): e0177937. Bibcode:2017PLoSO..1277937D. Дои:10.1371 / journal.pone.0177937. ISSN 1932-6203. ЧВК 5433771. PMID 28520817.
- ^ Хоу, Пей; У, Шилян (июль 2016 г.). «Долгосрочные изменения в метеорологии экстремального загрязнения воздуха и их влияние на качество воздуха». Научные отчеты. 6 (1): 23792. Bibcode:2016НатСР ... 623792H. Дои:10.1038 / srep23792. ISSN 2045-2322. ЧВК 4815017. PMID 27029386.
- ^ Тессум, Кристофер В .; Apte, Joshua S .; Добрый, Андрей Л .; Мюллер, Николас З .; Mullins, Kimberley A .; Паолелла, Дэвид А.; Поласки, Стивен; Спрингер, Натаниэль П .; Такрар, Сумил К. (11.03.2019). «Неравенство в потреблении товаров и услуг усугубляет расово-этнические различия в подверженности загрязнению воздуха». Труды Национальной академии наук. 116 (13): 6001–6006. Дои:10.1073 / pnas.1818859116. ISSN 0027-8424. ЧВК 6442600. PMID 30858319.
- ^ Американская ассоциация легких. (нет данных). Насколько здоровый воздух, которым вы дышите? Получено 20 марта 2019 г. с легкое.org
- ^ Колорадо Департамент общественного здравоохранения и окружающей среды. (2019, 4 января). История озона в Колорадо. Получено 20 марта 2019 г. с colorado.org
- ^ а б c Эванс, Джейсон М .; Хельмиг, Детлев (февраль 2017 г.). «Исследование влияния транспорта из нефтегазовых регионов на повышенные уровни озона в северной части Колорадо». Журнал Ассоциации управления воздухом и отходами. 67 (2): 196–211. Дои:10.1080/10962247.2016.1226989. ISSN 1096-2247. PMID 27629587.
- ^ Департамент здравоохранения и окружающей среды штата Колорадо, Региональный совет по качеству воздуха и Организация городского планирования Северного фронта. «План действий по озону Колорадо» (PDF). dx.doi.org. Получено 2019-03-21.CS1 maint: несколько имен: список авторов (связь)
- ^ Колорадо Департамент общественного здравоохранения и окружающей среды. (нет данных). Колорадо качества воздуха. Получено 20 марта 2019 г. с сайта https://www.colorado.gov/airquality/air_quality.aspx.
- ^ Layer, Роберт В .; Латтимер, Роберт П. (июль 1990 г.). «Защита резины от озона». Химия и технология резины. 63 (3): 426–450. Дои:10.5254/1.3538264.
- ^ «Тропосферный озон в ЕС - сводный отчет». Европейское агентство по окружающей среде. 1998 г.. Получено 2006-05-10.
- ^ «Химия атмосферы и парниковые газы». Межправительственная комиссия по изменению климата. Архивировано из оригинал на 2006-07-10. Получено 2006-05-10.
- ^ «Изменение климата 2001». Межправительственная комиссия по изменению климата. 2001. Архивировано с оригинал на 2006-09-13. Получено 2006-09-12.
- ^ Методология оценки жизненного цикла, достаточная для поддержки публичных заявлений и претензий, проект стандарта комитета, версия 2.1. Системы научной сертификации, февраль 2011 г. Приложение B, раздел 4.
- ^ НАСА ГОДДАРД ГЛАВНАЯ СТРАНИЦА ПО ТРОПОСФЕРНОМУ ОЗОНУ НАСА Центр космических полетов Годдарда Код 613.3, Отделение химии и динамики. Acdb-ext.gsfc.nasa.gov (20 сентября 2006 г.). Проверено 1 февраля 2012.
- ^ Стюарт, Д. Р .; Saunders, E .; Perea, R.A .; Fitzgerald, R .; Кэмпбелл, Д. Э .; Стоквелл, У. Р. (13 ноября 2017 г.). «Связывание моделей воздействия на качество воздуха и здоровья человека: приложение к воздушному бассейну Лос-Анджелеса». Анализ состояния окружающей среды и здоровья. 11: 1178630217737551. Дои:10.1177/1178630217737551. ЧВК 5692127. PMID 29162976.
- ^ Агентство по охране окружающей среды США, OAR (5 июня 2015 г.). «Влияние загрязнения озоном на здоровье». Агентство по охране окружающей среды США.
- ^ Агентство по охране окружающей среды США, OAR (2015-05-29). «Основы приземного озона». Агентство по охране окружающей среды США. Получено 2020-11-26.
- ^ а б Научная и медицинская редакционная коллегия Американской ассоциации легких. «Озон». Американская ассоциация легких. Получено 24 марта 2019.
- ^ Jule, Y .; Michaudel, C .; Fauconnier, L .; Togbe, D .; Риффель, Б. (2018). «Озон-индуцированные острые и хронические изменения в легких у мышей: комбинированная цифровая визуализация и функциональный анализ». Европейский респираторный журнал. 52: 4313.
- ^ Burnett, R.T .; Brook, J. R .; Yung, W. T .; Dales, R.E .; Кревски, Д. (1997). «Ассоциация между озоном и госпитализацией при респираторных заболеваниях в 16 городах Канады». Экологические исследования. 72 (1): 24–31. Bibcode:1997ER ..... 72 ... 24B. Дои:10.1006 / enrs.1996.3685. PMID 9012369.
- ^ Desqueyroux, H .; Pujet, J.C .; Проспер, М .; Squinazi, F .; Момас, И. (2002). «Краткосрочные последствия низкого уровня загрязнения воздуха для здоровья органов дыхания взрослых, страдающих астмой средней и тяжелой степени». Экологические исследования. 89 (1): 29–37. Bibcode:2002ER ..... 89 ... 29D. Дои:10.1006 / enrs.2002.4357. PMID 12051782.
- ^ Gent, J. F .; Triche, E.W .; Holford, T. R .; Belanger, K .; Bracken, M. B .; Beckett, W. S .; Лидерер, Б. П. (2003). «Связь низкого уровня озона и мелких частиц с респираторными симптомами у детей с астмой». JAMA. 290 (14): 1859–1867. Дои:10.1001 / jama.290.14.1859. PMID 14532314.
- ^ а б c d е ж Аль-Хегелан М., Тайге Р.М., Кастильо С., Холлингсворт Дж. У. Окружающий озон и врожденный иммунитет легких // Immunol Res. 2011; 49 (1-3): 173-91.
- ^ а б c d Информированное здоровье в Интернете [Интернет]. Кельн, Германия: Институт качества и эффективности здравоохранения (IQWiG); 2006-. Врожденная и адаптивная иммунные системы. 7 декабря 2010 г. [Обновлено 4 августа 2016 г.]. Доступна с https://www.ncbi.nlm.nih.gov/books/NBK279396/
- ^ а б c d е Джейнвей К.А. младший, Трэверс П., Уолпорт М. и др. Иммунобиология: иммунная система в здоровье и болезнях. 5-е издание. Нью-Йорк: наука о гирляндах; 2001. Компоненты иммунной системы. Доступна с: https://www.ncbi.nlm.nih.gov/books/NBK27092/
- ^ Gold, D. R .; Litonjua, A .; Schwartz, J .; Lovett, E .; Larson, A .; Баринг, Б .; Верье, Р. (2000). «Загрязнение окружающей среды и вариабельность сердечного ритма». Тираж. 101 (11): 1267–1273. Дои:10.1161 / 01.cir.101.11.1267. PMID 10725286.
- ^ Sarnat, S.E .; Suh, H.H .; Coull, B.A .; Schwartz, J .; Stone, P.H .; Голд, Д. Р. (2006). «Загрязнение атмосферного воздуха частицами и сердечная аритмия на группе пожилых людей в Стьубенвилле, штат Огайо». Медицина труда и окружающей среды. 63 (10): 700–706. Дои:10.1136 / oem.2006.027292. ЧВК 2078044. PMID 16757505.
- ^ Brook, R.D .; Brook, J. R .; Urch, B .; Vincent, R .; Rajagopalan, S .; Сильверман, Ф. (2002). «Вдыхание мелких частиц загрязнения воздуха и озона вызывает острую артериальную вазоконстрикцию у здоровых взрослых». Тираж. 105 (13): 1534–1536. Дои:10.1161 / 01.cir.0000013838.94747.64. PMID 11927516.
- ^ Zanobetti, A .; Каннер, М. Дж .; Stone, P.H .; Schwartz, J .; Шер, Д .; Eagan-Bengston, E .; Голд, Д. Р. (2004). «Загрязнение окружающей среды и артериальное давление у кардиологических реабилитационных пациентов». Тираж. 110 (15): 2184–2189. Дои:10.1161 / 01.cir.0000143831.33243.d8. PMID 15466639.
- ^ Тернер, М. С .; Jerrett, M .; Папа III; Кревски, Д .; Gapstur, S.M .; Diver, W. R .; Бернетт, Р. Т. (2016). «Долгосрочное воздействие озона и смертность в большом проспективном исследовании». Американский журнал респираторной медицины и реанимации. 193 (10): 1134–1142. Дои:10.1164 / rccm.201508-1633oc. ЧВК 4872664. PMID 26680605.
- ^ Crouse, D. L .; Peters, P. A .; Hystad, P .; Brook, J. R .; van Donkelaar, A .; Мартин, Р. В .; Брауэр, М. (2015). «Воздействие PM2,5, O3 и NO2 в окружающем воздухе и связь со смертностью в течение 16 лет наблюдения в когорте Канадской переписи населения, здоровья и окружающей среды (CanCHEC)». Перспективы гигиены окружающей среды. 123 (11): 1180–1186. Дои:10.1289 / ehp.1409276. ЧВК 4629747. PMID 26528712.
- ^ Джерретт, Майкл; Бернетт, Ричард Т .; Поуп К. Арден; Ито, Кадзухико; Терстон, Джордж; Кревски, Даниэль; Ши, Юаньли; Калле, Евгения; Тун, Майкл (12 марта 2009 г.). «Долгосрочное воздействие озона и смертность». Медицинский журнал Новой Англии. 360 (11): 1085–1095. Дои:10.1056 / NEJMoa0803894. ISSN 0028-4793. ЧВК 4105969. PMID 19279340.
- ^ Lin, S .; Лю, X .; Le, L.H .; Хван, С. А. (2008). «Хроническое воздействие окружающего озона и госпитализация детей при астме». Перспективы гигиены окружающей среды. 116 (12): 1725–1730. Дои:10.1289 / ehp.11184. ЧВК 2599770. PMID 19079727.
- ^ Zu, K .; Shi, L .; Prueitt, R.L .; Лю, X .; Гудман, Дж. Э. (2018). «Критический обзор долгосрочного воздействия озона и развития астмы». Ингаляционная токсикология. 30 (3): 99–113. Дои:10.1080/08958378.2018.1455772. PMID 29869579.
- ^ Malig, B.J .; Pearson, D. L .; Chang, Y.B .; Broadwin, R .; Basu, R .; Грин, Р. С .; Остро, Б. (2015). «Стратифицированное по времени перекрестное исследование воздействия озона в окружающей среде и посещения отделений неотложной помощи для конкретных респираторных диагнозов в Калифорнии (2005–2008 гг.)». Перспективы гигиены окружающей среды. 124 (6): 745–753. Дои:10.1289 / ehp.1409495. ЧВК 4892911. PMID 26647366.
- ^ Vanwinge, C .; Gilles, C .; Джерард, К .; Blacher, S .; Ноэль, А .; Cataldo, D .; Скалы, Н. (2017). «Роль загрязнения озоном в прогрессировании рака легких». Am J Respir Crit Care Med. 195: A2352.
- ^ Ware, L.B .; Zhao, Z .; Koyama, T .; Мэй, А.К .; Matthay, M.A .; Lurmann, F.W .; Калфи, С. С. (2016). «Длительное воздействие озона увеличивает риск развития острого респираторного дистресс-синдрома». Американский журнал респираторной медицины и реанимации. 193 (10): 1143–1150. Дои:10.1164 / rccm.201507-1418oc. ЧВК 4872663. PMID 26681363.
- ^ Сертифицированные в Калифорнии устройства для очистки воздуха. Из Калифорнийский совет по воздушным ресурсам.
- ^ Джинни Аллен (22 августа 2003 г.). "Наблюдая за нашей озоновой погодой". Земная обсерватория НАСА. Получено 2008-10-11.
- ^ Ответ на дополнительные вопросы CAFE (2004 г.) В архиве 2005-09-09 на Wayback Machine (PDF)
- ^ EPA Разработчики курсов (2016-03-21). «Влияние озона на здоровье населения в целом». EPA.
- ^ а б c Вайнхольд Б (2008). «Озоновая нация: стандарт EPA подвергается критике». Environ. Перспектива здоровья. 116 (7): A302 – A305. Дои:10.1289 / ehp.116-a302. ЧВК 2453178. PMID 18629332.
- ^ Джерретт, Майкл; Бернетт, Ричард Т .; Папа, К. Арден, III; Ито, Кадзухико; Терстон, Джордж; Кревски, Даниэль; Ши, Юаньли; Калле, Евгения; Тун, Майкл (12 марта 2009 г.). «Долгосрочное воздействие озона и смертность». N. Engl. J. Med. 360 (11): 1085–1095. Дои:10.1056 / NEJMoa0803894. ЧВК 4105969. PMID 19279340.
- ^ Уилсон, Элизабет К. (16 марта 2009 г.). «Воздействие озона на здоровье». Новости химии и машиностроения. 87 (11): 9. Дои:10.1021 / cen-v087n011.p009a.
- ^ Даль, Р. (2006). «Озоновая перегрузка: действующие стандарты не могут защитить здоровье». Environ. Перспектива здоровья. 114 (4): A240. Дои:10.1289 / ehp.114-a240a. ЧВК 1440818.
- ^ Белл, ML; Peng, RD; Dominici, F (2006). «Кривая« воздействие-реакция »для озона и риск смертности и соответствие действующим нормам по озону». Environ. Перспектива здоровья. 114 (4): 532–6. Дои:10.1289 / ehp.8816. ЧВК 1440776. PMID 16581541.
- ^ Директива 2008/50 / EC. Eur-lex.europa.eu. Проверено 17 января 2013.
- ^ «ДИРЕКТИВА 2008/50 / EC по качеству окружающего воздуха и более чистому воздуху для Европы». EC. 2008-06-11. Получено 2010-08-23.
- ^ «Комментарии Американской ассоциации легких, Защиты окружающей среды, Sierra Club относительно предлагаемых поправок Агентства по охране окружающей среды США к национальным стандартам качества атмосферного воздуха для озона 11 июля 2007 г. - 72 FR 37818» (PDF). Lungusa.org. Архивировано из оригинал (PDF) 10 июля 2010 г.
- ^ «Загрязнение атмосферного (наружного) воздуха». www.who.int. Получено 2020-07-31.
- ^ Национальные стандарты качества атмосферного воздуха для озона. Агентство по охране окружающей среды (EPA). Предлагаемое правило
- ^ «Федеральный регистр | Национальные стандарты качества атмосферного воздуха для озона». www.federalregister.gov. 2015-10-26. Получено 2016-05-16.
- ^ Что такое озон? airinfonow.org
- ^ Андерсон, В .; G.J. Прескотт; С. Пакхэм; Дж. Маллинз; М. Брукс; А. Ситон (2001). «Признания астмы и грозы: исследование пыльцы, спор грибов, дождя и озона». QJM: Международный медицинский журнал. 94 (8): 429–433. Дои:10.1093 / qjmed / 94.8.429. PMID 11493720.
- ^ Пресс-релиз Университета Восточной Англии, Клонирование запаха моря, 2 февраля 2007 г.
- ^ Косацкий Т. (июль 2005 г.). "Волны жары в Европе 2003 г.". Евронаблюдение. 10 (7): 3–4. Дои:10.2807 / esm.10.07.00552-ru. PMID 29208081. Получено 14 января, 2014.
- ^ Хоффманн, Роальд (январь 2004 г.). "История О". Американский ученый. 92 (1): 23. Дои:10.1511/2004.1.23. Архивировано из оригинал на 2006-09-25. Получено 2006-10-11.
- ^ Смит, LL (2004). «Кислород, оксистерины, уабаин и озон: поучительная история». Свободная радикальная биология и медицина. 37 (3): 318–24. Дои:10.1016 / j.freeradbiomed.2004.04.024. PMID 15223065.
- ^ Пол Вентворт; Ниева, Дж; Такеучи, К; Galve, R; Вентворт, AD; Дилли, РБ; Делария, Джорджия; Савен, А; и другие. (2003). «Доказательства образования озона в атеросклеротических артериях человека». Наука. 302 (5647): 1053–6. Bibcode:2003Наука ... 302.1053W. Дои:10.1126 / science.1089525. PMID 14605372. S2CID 11099904.
- ^ Иглесиас, Доминго Дж .; Анхелес Калатаюда; Ева Барреноб; Эдуардо Примо-Миллоа; Мануэль Талон (2006). «Реакция цитрусовых на озон: биохимия листьев, антиоксидантные механизмы и перекисное окисление липидов». Физиология и биохимия растений. 44 (2–3): 125–131. Дои:10.1016 / j.plaphy.2006.03.007. PMID 16644230.
- ^ а б Бортолин, Рафаэль Каликсто; Кареньато, Фернанда Фрейтас; Диван, Армандо Молина; Регинатто, Флавио Энрике; Гелайн, Даниэль Пенс; Морейра, Хосе Клаудио Фонсека (01.02.2014). «Влияние хронической повышенной концентрации озона на окислительно-восстановительное состояние и урожайность красного перца Capsicum baccatum». Экотоксикология и экологическая безопасность. 100: 114–121. Дои:10.1016 / j.ecoenv.2013.09.035. ISSN 0147-6513. PMID 24238720.
- ^ а б Бортолин, Рафаэль Каликсто; Кареньато, Фернанда Фрейтас; Диван Джуниор, Армандо Молина; Занотто-Филью, Алфеу; Мореско, Карла Сузана; де Оливейра Риос, Алессандро; де Оливейра Сальви, Агуиссон; Ортманн, Кэролайн Флах; де Карвалью, Памела (1 июля 2016 г.). «Хроническое воздействие озона изменяет профиль вторичных метаболитов, антиоксидантный потенциал, противовоспалительные свойства и качество плодов красного перца Capsicum baccatum». Экотоксикология и экологическая безопасность. 129: 16–24. Дои:10.1016 / j.ecoenv.2016.03.004. ISSN 0147-6513. PMID 26970882.
- ^ Каковы основные опасности для здоровья, связанные с вдыханием озона?, Канадский центр охраны труда и техники безопасности
- ^ Документация по концентрации, непосредственно опасной для жизни или здоровья (IDLH): Перечень химикатов NIOSH и документация пересмотренных значений IDLH (по состоянию на 3/1/95)
- ^ а б Лай, Дженнифер (2008-05-08). "Самолет в воздухе тяжелый на озоне - Ежедневный обзор ". Portfolio.com. Проверено 1 февраля 2012 г.
- ^ Качество воздуха в самолетах: виноваты озон и натуральные масла. Sciencedaily.com (2007-09-05). Проверено 1 февраля 2012 г.
- ^ «Визуальная энциклопедия химической инженерии». encyclopedia.che.engin.umich.edu.
- ^ https://www.a2zozone.com/blogs/news/ozone-tube-vs-ozone-plate
- ^ Smith, L.I .; Greenwood, F. L .; Худрлик, О. (1946). «Лабораторный озонатор». Органический синтез. 26: 63.; Коллективный объем, 3, п. 673
- ^ Dohan, J.M .; W. J. Masschelein (1987). «Фотохимическое образование озона: современное состояние». Ozone Sci. Англ.. 9 (4): 315–334. Дои:10.1080/01919518708552147.
- ^ Гуджрал, Сарбджит Сингх; и другие. (2013). «Озонотерапия: веха в лечении болезней» (PDF). Indo Global Journal of Pharmaceutical Sciences. 3 (2): 167–173.
- ^ Фоллер, Питер С .; Тобиас, Чарльз В. (1982). «Анодная эволюция озона». Журнал Электрохимического общества. 129 (3): 506. Дои:10.1149/1.2123890.
- ^ Арихара, Кадзуки; Терасима, Чиаки; Фудзишимам Акира (2007). «Электрохимическое производство озоновой воды высокой концентрации с использованием отдельно стоящих перфорированных алмазных электродов». Журнал Электрохимического общества. 154 (4): E71. Дои:10.1149/1.2509385.
- ^ Хейл, Артур Дж. (1919). Производство химикатов электролизом. D. Van Nostrand Co., стр. 15, 16. Получено 12 сентября 2019.
- ^ "Лабораторная запись №106 Воздействие дугогасителя на окружающую среду". Технологии гашения дуги. Апрель 2011 г.. Получено 10 октября, 2011.
- ^ ¿Relámpagos del Catatumbo восстанавливать капа озоно? В архиве 2016-03-05 в Wayback Machine. Agencia de noticias de la Universidad del Zulia.
- ^ «Огонь в небе». Архивировано из оригинал на 2011-07-21. Получено 2008-08-16.
- ^ Ибанез, Хорхе Дж .; Родриго Майен-Мондрагон; М. Т. Моран-Моран (2005). «Лабораторные эксперименты по электрохимическому восстановлению окружающей среды. Часть 7: Производство озона в микромасштабах». Журнал химического образования. 82 (10): 1546. Bibcode:2005JChEd..82.1546A. Дои:10.1021 / ed082p1546.
- ^ «Удаление озона и цвета». Информация об озоне. Архивировано из оригинал на 2011-07-15. Получено 2009-01-09.
- ^ Hoigné, J. (1998). Справочник по химии окружающей среды, Vol. 5 часть C. Берлин: Springer-Verlag. С. 83–141.
- ^ «Окислительный потенциал озона». Ozone-Information.com. Архивировано из оригинал на 2008-04-19. Получено 2008-05-17.
- ^ «Обеззараживание: озон по спорам». Развитие больницы. Wilmington Media Ltd. 1 апреля 2007 г. Архивировано из оригинал на 2007-09-29. Получено 2007-05-30.
- ^ а б c Монтекальво, Джозеф; Дуг Уильямс. «Применение озонирования в очистке сточных вод овощных производств» (PDF). Калифорнийский политехнический государственный университет. Архивировано из оригинал (PDF) 28 мая 2008 г.. Получено 2008-03-24.
- ^ Стивз, Сьюзан А. (30 января 2003 г.). «Озон может обеспечить экологически безопасную защиту зерна». Purdue News.
- ^ «Химический синтез с озоном». Ozone-Information.com. Архивировано из оригинал на 2008-04-10. Получено 2008-05-17.
- ^ «Очистка и отбеливание тканей озоном» (PDF).
- ^ де Бур, Герой Э. Л .; ван Эльзелинген-Деккер, Карла М .; van Rheenen-Verberg, Cora M. F .; Spanjaard, Lodewijk (октябрь 2006 г.). «Использование газообразного озона для искоренения метициллин-устойчивого Staphylococcus aureus из домашней среды колонизированного сотрудника больницы». Инфекционный контроль и больничная эпидемиология. 27 (10): 1120–1122. Дои:10.1086/507966. JSTOR 507966. PMID 17006820.
- ^ Шёстрём, Ээро (1993). Химия древесины: основы и приложения. Сан-Диего, Калифорния: Academic Press, Inc. ISBN 978-0-12-647481-7.
- ^ Су, Ю-Чанг; Чен, Хорнг-Цай (2001). «Последовательность энзонового отбеливания и изменение цвета озоно-отбеленной целлюлозы». Тайваньский лесной журнал. 16 (2): 93–102.
- ^ Боллыки, Л. Дж. (1977). Озонирование цианидсодержащих отходов, EPA Report 600 / 2-77-104. Research Triangle Park, Северная Каролина: Агентство по охране окружающей среды США.
- ^ Сименс, Вернер (1857). «Об электростатической индукции и задержке тока в проводах бутылки». Анналы физики. 178 (9): 66. Дои:10.1002 / andp.18571780905.
- ^ а б Агентство по охране окружающей среды США. (2009). «База данных по очистке питьевой воды».
- ^ а б Сорлини, Сабрина; Collivignarelli, Карло (2005). «Образование тригалометана при химическом окислении хлором, диоксидом хлора и озоном десяти итальянских природных вод». Опреснение. 176 (1–3): 103–111. Дои:10.1016 / j.desal.2004.10.022.
- ^ Галлард, Эрве; Гунтен, Урс фон (2002). «Хлорирование природного органического вещества: кинетика хлорирования и образования ТГМ». Водные исследования. 36 (1): 65–74. Дои:10.1016 / S0043-1354 (01) 00187-7. PMID 11766819.
- ^ Croué, J. P .; Koudjonou, B.K .; Легубе, Б. (1996). «Параметры, влияющие на образование бромат-иона при озонировании».
- ^ Siddiqui, Mohamed S .; Эми, Гэри Л. (1993). «Факторы, влияющие на образование ДАД при озон-бромидных реакциях». Американская ассоциация водопроводных сооружений. 85 (1): 63–72. Дои:10.1002 / j.1551-8833.1993.tb05922.x.
- ^ Всемирная организация здоровья. (2003). «Атразин в питьевой воде: исходный документ для разработки руководящих принципов ВОЗ по качеству питьевой воды».
- ^ Khadre, M. A .; Юсеф, А. Э .; Ким, Джей-Джи. (2001). «Микробиологические аспекты применения озона в продуктах питания: обзор». Журнал пищевой науки. 66 (9): 1242–1252. Дои:10.1111 / j.1365-2621.2001.tb15196.x.
- ^ Муйович, Сельман; Фостер, Джон Э. (2018). «Физика плазмы и химия для повторного использования воды: масштабирование границы раздела плазма-вода как альтернатива АОП». Материалы Федерации водной среды 2018. 15: 1969–1983.
- ^ Гузель-Сейдим, Зейнеп Б .; Грин, Аннел К .; Сейдим, А. С. (2004). «Использование озона в пищевой промышленности». LWT-Пищевая наука и технологии. 37 (4): 453–460. Дои:10.1016 / j.lwt.2003.10.014.
- ^ Вешлер, Чарльз Дж. (2000). «Озон в помещениях: концентрация и химический состав». Внутренний воздух. 10 (4): 269–288. Дои:10.1034 / j.1600-0668.2000.010004269.x. PMID 11089331.
- ^ Чоудхури, Бхасвати; Португалия, Шерли; Мастаная, Навья; Джонсон, Джудит А .; Рой, Субрата (2018). «Инактивация Pseudomonas aeruginosa и метициллин-резистентного золотистого стафилококка в открытой водной системе озоном, генерируемым компактным атмосферным плазменным реактором DBD». Научные отчеты. 8 (1): 17573. Bibcode:2018НатСР ... 817573C. Дои:10.1038 / s41598-018-36003-0. ЧВК 6279761. PMID 30514896.
- ^ Чоудхури, Бхасвати; Португалия, Шерли; Джонсон, Джудит А .; Рой, Субрата (2020). «Оценка производительности вентиляторных и гребенчатых плазменных реакторов для распределения образующегося озона в ограниченном пространстве». Форум AIAA Scitech 2020: 1165.
- ^ Выпущено в США 10,651,014, Subrata Roy & Sherlie Portugal, «Компактный переносной плазменный реактор», выпущенный 12 мая 2020 г.
- ^ Драу, Абделькадер; Неммич, Саид; Нассур, Камель; Бенмимун, Юсеф; Тилматин, Амар (2019). «Экспериментальный анализ новой конфигурации генератора озона для использования в системах очистки воды». Международный журнал экологических исследований. 76 (2): 338–350. Дои:10.1080/00207233.2018.1499698. S2CID 105285760.
- ^ Зито, Джастин С .; Дуршер, Райан Дж .; Сони, Джигнеш; Рой, Субрата; Арнольд, Дэвид П. (2012). «Создание потока и силы с помощью приводов с диэлектрическим барьером микронного размера». Письма по прикладной физике. 100 (19): 193502. Bibcode:2012АпФЛ.100с3502З. Дои:10.1063/1.4712068.
- ^ Кувшинов Дмитрий; Лозано-Парада, Хайме; Сисванто, Анггун; Циммерман, Уильям (2014). «Эффективный компактный плазменный реактор micro DBD для генерации озона для промышленного применения в жидких и газофазных системах». Международный журнал химической, молекулярной, ядерной техники, материалов и металлургической инженерии. 8 (1).
- ^ Отчет EPA о потребительских очистителях воздуха с озоном. Epa.gov. Проверено 1 февраля 2012 г.
- ^ Лонг, Рон (2008). «Очистка пищевых продуктов озоном POU: жизнеспособный вариант для потребителей и предприятий общественного питания» (PDF). Архивировано из оригинал (PDF) на 2011-07-15. (отчет также показывает, что водопроводная вода удаляет 99,95% патогенов из салата; образцы были заражены патогенами перед обработкой)
- ^ Терсано Инк (2007). "Лотос очищает пищу без химикатов". Архивировано из оригинал на 2007-02-11. Получено 2007-02-11.
- ^ Йонген, В. (2005). Повышение безопасности свежих фруктов и овощей. Бока-Ратон: Woodhead Publishing Ltd. ISBN 978-1-85573-956-7.
- ^ «Руководство по альтернативным дезинфицирующим средствам и окислителям» (PDF). Агентство по охране окружающей среды США. Апрель 1999 г.. Получено 2008-01-14.
- ^ Благородный, A.C .; Саммерфельт, С. (1996). «Заболевания радужной форели, выращиваемой в рециркуляционных системах». Ежегодный обзор болезней рыб. 6: 65–92. Дои:10.1016 / S0959-8030 (96) 90006-X.
- ^ Феррейра, О; де Коста, О.Т .; Феррейра, Сантос; Мендонка, Ф. (2004). «Восприимчивость амазонских рыб Colossoma macropomum (Serrasalminae) к кратковременному воздействию нитритов». Аквакультура. 232 (1–4): 627–636. Дои:10.1016 / S0044-8486 (03) 00524-6.
- ^ Ribeiro, A.R.A .; Ribeiro, L .; Saele, Ø .; Hamre, K .; Dinis, M.T .; Морен, М. (2009). «Обогащенные йодом коловратки и артемия предотвращают зоб у личинок сенегальской камбалы (Solea senegalensis), выращиваемых в системе рециркуляции». Питание аквакультуры. 17 (3): 248–257. Дои:10.1111 / j.1365-2095.2009.00740.x.
- ^ Buchan, K .; Martin-Robinchaud, D .; Benfey, T.J .; Маккиннон, А; Бостон, L (2006). «Эффективность озонированной морской воды для дезинфекции поверхности яиц пикши (Melanogrammus aeglefinus) против piscine nodavirus». Аквакультурная инженерия. 35: 102–107. Дои:10.1016 / j.aquaeng.2005.10.001.
- ^ Alothman, M .; Kaur, B .; Fazilah, A .; Бхат, Раджив; Карим, псевдоним А. (2010). «Озон-индуцированные изменения антиоксидантной способности свежесрезанных тропических фруктов». Инновационная наука о продуктах питания и новые технологии. 11 (4): 666–671. Дои:10.1016 / j.ifset.2010.08.008.
- ^ Tzortzakis, N .; Borland, A .; Синглтон, I .; Барнс, Дж (2007). «Влияние обогащения атмосферы озоном на качественные характеристики плодов томата». Послеуборочная биология и технология. 45 (3): 317–325. Дои:10.1016 / j.postharvbio.2007.03.004.
- ^ Keutgen, A.J .; Павелзик, Э. (2008). «Влияние предуборочного воздействия озона на качество плодов клубники в смоделированных розничных условиях». Послеуборочная биология и технология. 49: 10–18. Дои:10.1016 / j.postharvbio.2007.12.003.
- ^ Lestan, D .; Hanc, A .; Финцгар, Н. (2005). «Влияние озонирования на экстрагируемость Pb и Zn из загрязненных почв». Атмосфера. 61 (7): 1012–1019. Bibcode:2005Чмсп..61.1012Л. Дои:10.1016 / j.chemosphere.2005.03.005. PMID 16257321.
- ^ а б Plaue, J.W .; Червински, К. (2003). «Влияние озона на лиганд-ассистированную экстракцию 239Pu и 241Am из почвы каменистых равнин». Радиохим. Acta. 91 (6–2003): 309–313. Дои:10.1524 / ract.91.6.309.20026. S2CID 96019177.
- ^ «Кислородная терапия». Американское онкологическое общество. Архивировано 21 марта 2012 года.. Получено 29 ноябрь 2012.CS1 maint: неподходящий URL (связь)
дальнейшее чтение
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Беккер, К. Х., У. Когельшатц, К. Х. Шенбах, Р. Дж. Баркер (ред.). Неравновесная воздушная плазма при атмосферном давлении. Серия по физике плазмы. Бристоль и Филадельфия: Издательство «Институт физики»; ISBN 0-7503-0962-8; 2005
- Агентство по охране окружающей среды США. Группа рисков и выгод. (Август 2014 г.). Оценка риска для здоровья и воздействия озона: окончательный отчет.
внешняя ссылка
- Международная озоновая ассоциация
- Карта озона Европейского агентства по окружающей среде в режиме реального времени (ozoneweb)
- Страница ресурсов по озону НАСА
- Информация OSHA об озоне
- Пол Крутцен Интервью - Видео, на котором лауреат Нобелевской премии Пол Крутцен разговаривает с лауреатом Нобелевской премии Гарри Крото от Vega Science Trust
- Статья НАСА об озоне в Обсерватории Земли
- Международная карта химической безопасности 0068
- Карманный справочник NIOSH по химической опасности
- Национальный институт наук об окружающей среде, информация об озоне
- Загрязнение воздуха озоном на уровне земли
- Исследование НАСА связывает "смог" с потеплением Арктики —НАСА Годдард Исследование Института космических исследований (GISS) показывает эффект потепления озона в Арктике зимой и весной.
- Агентство по охране окружающей среды США ставит под сомнение эффективность или безопасность генераторов озона, продаваемых в качестве воздухоочистителей
- Информация об озоне на уровне земли от Американской ассоциации легких Новой Англии








![{displaystyle {ce {O2 -> [{ce {photon}}] [({ce {излучение}} лямбда <240 {ce {нм}})] 2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22c15c0d1b053ba02c27ceed129794d2cb91dd2a)

![{displaystyle {ce {3O2 -> [электричество] 2O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88e4bedbb91fdf257d5adad5b2fc99825be1cbb1)
