Монооксид углерода - Carbon monoxide - Wikipedia
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Монооксид углерода | |||
| Другие имена Монооксид углерода Оксид углерода Оксид углерода (II) Карбонил Дымовые газы Монооксид | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3587264 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.010.118 | ||
| Номер ЕС |
| ||
| 421 | |||
| КЕГГ | |||
| MeSH | Углерод + монооксид | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1016 | ||
| |||
| |||
| Характеристики | |||
| CO | |||
| Молярная масса | 28,010 г / моль | ||
| Внешность | бесцветный газ | ||
| Запах | без запаха | ||
| Плотность | 789 кг / м3, жидкость 1.250 кг / м3 при 0 ° C, 1 атм 1.145 кг / м3 при 25 ° C, 1 атм | ||
| Температура плавления | -205,02 ° С (-337,04 ° F, 68,13 К) | ||
| Точка кипения | -191,5 ° С (-312,7 ° F, 81,6 К) | ||
| 27,6 мг / л (25 ° С) | |||
| Растворимость | растворим в хлороформ, уксусная кислота, ацетат этила, этиловый спирт, гидроксид аммония, бензол | ||
Закон Генри постоянный (kЧАС) | 1,04 атм · м3/ моль | ||
| −9.8·10−6 см3/ моль | |||
| 1.0003364 | |||
| 0.122 D | |||
| Термохимия | |||
Теплоемкость (C) | 29,1 Дж / (К · моль) | ||
Стандартный моляр энтропия (S | 197,7 Дж / (моль · К) | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -110,5 кДж / моль | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | -283,4 кДж / моль | ||
| Фармакология | |||
| V04CX08 (ВОЗ) | |||
| Опасности | |||
| Паспорт безопасности | Видеть: страница данных ICSC 0023 | ||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| H220, H331, H360, H372 | |||
| P201, P202, P210, P260, P261, P264, P270, P271, P281, P304 + 340, P308 + 313, P311, P314, P321, P377, P381, P403, P403 + 233, P405, P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -191 ° С (-311,8 ° F, 82,1 К) | ||
| 609 ° С (1128 ° F, 882 К) | |||
| Пределы взрываемости | 12.5–74.2% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LC50 (средняя концентрация ) | 8636 частей на миллион (крыса, 15 мин) 5207 частей на миллион (крыса, 30 мин) 1784 частей на миллион (крыса, 4 ч) 2414 частей на миллион (мышь, 4 ч) 5647 частей на миллион (морская свинка, 4 ч)[1] | ||
LCLo (самый низкий опубликованный ) | 4000 частей на миллион (человек, 30 мин) 5000 частей на миллион (человек, 5 мин)[1] | ||
| NIOSH (Пределы воздействия на здоровье в США):[3] | |||
PEL (Допустимо) | TWA 50 частей на миллион (55 мг / м3) | ||
REL (Рекомендуемые) | TWA 35 частей на миллион (40 мг / м3) C 200 частей на миллион (229 мг / м3) | ||
IDLH (Непосредственная опасность) | 1200 частей на миллион | ||
| Родственные соединения | |||
Связанные оксиды углерода | Углекислый газ Недокись углерода Оксоуглероды | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Монооксид углерода (CO) представляет собой горючий газ без цвета, запаха и вкуса, который немного менее плотен, чем воздух. Токсично для животные это использование гемоглобин как переносчик кислорода (оба беспозвоночный и позвоночное животное ) при концентрациях выше примерно 35 промилле, несмотря на то что он также производится в небольших количествах при нормальном метаболизме животных., и считается, что имеет некоторые нормальные биологические функции. В атмосфере он пространственно изменчив и недолговечен, играя роль в образовании приземный озон.
Окись углерода состоит из одного углерод атом и один кислород атом, связанный тройная связь который состоит из двух чистых пи-облигации и один сигма-облигация. Это самый простой оксоуглерод и является изоэлектронный с другими трехсвязными двухатомный частицы, обладающие 10 валентными электронами, в том числе цианид анион, нитрозоний катион, монофторид бора и молекулярный азот. В координационные комплексы окись углерода лиганд называется карбонил.
История
Аристотель (384–322 гг. До н.э.) впервые зарегистрировали, что при сжигании углей образуются токсичные пары. Древний способ казни заключался в том, чтобы запереть преступника в ванной с тлеющими углями; однако тогда еще не было известно о механизме смерти. Греческий врач Гален (129–199 нашей эры) предположили, что произошло изменение в составе воздуха, которое причиняло вред при вдыхании.[5] В 1776 г. французский химик де Лассон произведенный CO при нагревании оксид цинка с кокс, но ошибочно пришли к выводу, что газообразный продукт был водород, как он горел синим пламенем. Газ был идентифицирован как соединение, содержащее углерод и кислород шотландским химиком Уильям Круикшанк в 1800 г.[6][7] Его токсические свойства на собаках были тщательно исследованы Клод Бернард около 1846 г.[8]
В течение Вторая Мировая Война, газовая смесь, включающая окись углерода, использовалась для сохранения автомобили работает в частях света, где бензин и дизельное топливо были редки. Внешние (за редким исключением) древесный уголь или генераторы древесного газа были установлены, и смесь атмосферного азота, водорода, окиси углерода и небольших количеств других газов, произведенных газификация был подан на газовый смеситель. Газовая смесь, полученная в результате этого процесса, известна как древесный газ. Окись углерода также широко использовалась во время Холокост некоторые Нацистские немецкие лагеря смерти, наиболее известный газовые фургоны в Хелмно, а в Действие T4 "эвтаназия "программа.[9]
Источники
Окись углерода образуется в результате частичного окисления углерод -содержащие соединения; он образуется, когда недостаточно кислорода для производства углекислый газ (CO2), например, при эксплуатации печь или двигатель внутреннего сгорания в закрытом помещении. В присутствии кислорода, в том числе в атмосферных концентрациях, окись углерода горит синим пламенем, образуя двуокись углерода.[10] Угольный газ, который широко использовался до 1960-х годов для домашнего освещения, приготовления пищи и отопления, в нем значительным топливным компонентом являлся оксид углерода. Некоторые процессы в современной технологии, такие как выплавка чугуна, по-прежнему производят окись углерода в качестве побочного продукта.[11] Во время окислительных процессов при производстве химикатов образуется большое количество побочного продукта CO. По этой причине отходящие технологические газы необходимо очищать. С другой стороны, прилагаются значительные исследовательские усилия для оптимизации условий процесса,[12] разработать катализатор с улучшенной селективностью [13] и понять пути реакции, ведущие к целевому продукту и побочным продуктам.[14][15]
Самый крупный источник окиси углерода в мире является естественным по происхождению из-за фотохимический реакции в тропосфера которые производят около 5 * 10 ^ 12 килограммов в год.[16] Другие естественные источники CO включают вулканы, лесные пожары, другие формы горения и молекулы, выделяющие монооксид углерода.
В биологии оксид углерода естественным образом образуется под действием гемоксигеназа 1 и 2 на гем из гемоглобин авария. Этот процесс дает определенное количество карбоксигемоглобин у нормальных людей, даже если они не дышат угарным газом. После первого сообщения о том, что окись углерода - это нормальное явление нейротрансмиттер в 1993 г.[17][18] а также один из трех газов, которые естественно модулируют воспалительные реакции в теле (два других оксид азота и сероводород ), монооксид углерода получил большое клиническое внимание как биологический регулятор. Известно, что во многих тканях все три газа действуют как противовоспалительные, вазодилататоры, и промоутеры неоваскулярный рост.[19] Клинические испытания небольшого количества окиси углерода в качестве лекарственного средства продолжаются.[20] Слишком много окиси углерода вызывает отравление угарным газом.
Известно, что некоторые виды морских глубоководных млекопитающих содержат в крови концентрация окиси углерода, которая напоминает уровни, наблюдаемые у хронических курильщиков сигарет.[21] Считается, что эти повышенные уровни CO увеличивают сродство животных к гемоглобину и кислороду, что может помочь животным более эффективно доставлять кислород во время тяжелых случаев гипоксемии, с которыми они обычно сталкиваются во время длительных погружений. Кроме того, эти уровни CO могут помочь животным в предотвращении травм, связанных с ишемией / реперфузией, связанных с физиологической реакцией на погружение.[22]
Молекулярные свойства
Окись углерода имеет молярная масса 28,0, что, согласно закон идеального газа, делает его немного менее плотным, чем воздух, средняя молярная масса которого составляет 28,8.
В длина облигации между атомом углерода и атомом кислорода составляет 112,8вечера.[23][24] Эта длина связи соответствует тройной связи, как в молекулярном азот (N2), который имеет аналогичную длину связи (109,76 пм) и почти такой же молекулярная масса. Двойные связи углерод – кислород значительно длиннее, 120,8 пм в формальдегид, Например.[25] Температура кипения (82 K) и точка плавления (68 K) очень похожи на температуры N2 (77 К и 63 К соответственно). В энергия диссоциации связи 1072 кДж / моль сильнее, чем у N2 (942 кДж / моль) и представляет собой самую прочную из известных химических связей.[26]
В земля электронное состояние окиси углерода - это синглетное состояние[27] так как неспаренных электронов нет.
Связующий и дипольный момент
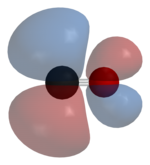
Углерод и кислород вместе имеют в сумме 10 электроны в валентной оболочки. После Правило октета как для углерода, так и для кислорода два атома образуют тройная связь, с шестью общими электронами на трех связывающих молекулярных орбиталях, а не с обычной двойной связью, обнаруживаемой в органических карбонильных соединениях. Поскольку четыре общих электрона происходят от атома кислорода и только два - от углерода, одна связывающая орбиталь занята двумя электронами кислорода, образуя дательный падеж или диполярная связь. Это вызывает C ← O поляризация молекулы с небольшим отрицательным зарядом углерода и небольшим положительным зарядом кислорода. Две другие связывающие орбитали каждая занята одним электроном от углерода и одной из кислорода, образуя (полярные) ковалентные связи с обратной поляризацией C → O, поскольку кислород больше электроотрицательный чем углерод. В свободной молекуле окиси углерода суммарный отрицательный заряд δ– остается на углеродном конце, и молекула имеет небольшой дипольный момент из 0,122D.[28]
Следовательно, молекула асимметрична: кислород имеет большую электронную плотность, чем углерод, а также слегка положительно заряжен по сравнению с отрицательным углеродом. Напротив, изоэлектронный Молекула диазота не имеет дипольного момента.
Окись углерода имеет вычисленный дробный порядок связи 2,6, что указывает на то, что «третья» связь важна, но составляет несколько меньшую, чем полная связь.[29] Таким образом, в терминах валентных облигаций –C≡O+ является наиболее важной структурой, в то время как: C = O не является октетом, но имеет нейтральный формальный заряд на каждом атоме и представляет собой второй по значимости вклад в резонанс. Из-за неподеленной пары и двухвалентности углерода в этой резонансной структуре монооксид углерода часто считается чрезвычайно стабилизированным. карбен.[30] Изоцианиды представляют собой соединения, в которых О заменен группой NR (R = алкил или арил) и имеют аналогичную схему связывания.
Если окись углерода действует как лиганд, полярность диполя может измениться с результирующим отрицательным зарядом на кислородном конце, в зависимости от структуры координационный комплекс.[31]Также раздел «Координационная химия» ниже.
Полярность связи и степень окисления
Теоретические и экспериментальные исследования показывают, что, несмотря на большую электроотрицательность кислорода, дипольный момент указывает от более отрицательного конца углерода к более положительному концу кислорода.[32][33] Фактически, эти три облигации полярные ковалентные связи которые сильно поляризованы. Расчетная поляризация к атому кислорода составляет 71% для σ-связь и 77% для обоих π-связи.[34]
В степень окисления углерода в окиси углерода +2 в каждой из этих структур. Он рассчитывается путем подсчета всех связывающих электронов как принадлежащих к более электроотрицательному кислороду. Только два несвязывающих электрона на углероде относятся к углероду. Таким образом, углерод имеет только два валентных электрона в молекуле по сравнению с четырьмя в свободном атоме.
Биологические и физиологические свойства
Токсичность
Отравление угарным газом это самый распространенный тип смертельного отравления воздуха во многих странах.[35] Окись углерода бесцветна, без запаха и вкуса, но очень токсична. Он сочетается с гемоглобин производить карбоксигемоглобин, связываясь с участком в гемоглобине, который обычно переносит кислород, делая его неэффективным для доставки кислорода к тканям организма. Концентрация всего 667 промилле может вызвать превращение до 50% гемоглобина в организме в карбоксигемоглобин.[36] Уровень карбоксигемоглобина 50% может привести к судорогам, коме и летальному исходу. В Соединенных Штатах OSHA ограничивает уровни долгосрочного воздействия на рабочем месте выше 50 ppm.[37]
Наиболее частые симптомы отравления угарным газом могут напоминать другие типы отравлений и инфекций, включая такие симптомы, как Головная боль, тошнота, рвота, головокружение, усталость, и чувство слабости. Пострадавшие семьи часто считают себя жертвами пищевого отравления. Младенцы могут быть раздражительными и плохо питаться. Неврологические признаки включают спутанность сознания, дезориентацию, нарушение зрения, обморок (обмороки) и судороги.[38]
Некоторые описания отравления угарным газом включают: сетчатка кровоизлияния и необычный вишнево-красный оттенок крови.[39] В большинстве клинических диагнозов эти признаки редко замечаются.[38] Одна из трудностей с пользой этого вишнево-красного эффекта заключается в том, что он исправляет или маскирует то, что в противном случае было бы нездоровым, поскольку главный эффект удаления деоксигенированного гемоглобина - сделать человека, страдающего асфиксией, более нормальным или мертвого человека. более реалистичный, похожий на действие красных красителей в жидкости для бальзамирования. «Ложный» или нефизиологический эффект красного окрашивания в ткани, отравленной аноксическим CO, связан с коммерческим использованием окиси углерода для окрашивания мяса, обсуждаемым ниже.
Окись углерода также связывается с другими молекулами, такими как миоглобин и митохондриальный цитохромоксидаза. Воздействие окиси углерода может вызвать значительный ущерб сердце и Центральная нервная система, особенно бледный шар,[40] часто с длительные хронические патологические состояния. Окись углерода может оказывать серьезное неблагоприятное воздействие на плод беременной женщины.[41]
Нормальная физиология человека
Окись углерода вырабатывается естественным путем в организме человека как сигнальная молекула. Таким образом, окись углерода может иметь физиологическую роль в организме, например, нейротрансмиттер или релаксант кровеносных сосудов.[42] Из-за роли окиси углерода в организме нарушения его метаболизма связаны с различными заболеваниями, включая нейродегенерации, гипертонию, сердечную недостаточность и патологическое воспаление.[42] По сравнению с воспалением, угарный газ подавляет движение лейкоциты к воспаленным тканям, стимулирует лейкоциты фагоцитоз бактерий и уменьшают выработку провоспалительных цитокины лейкоцитами. Кроме того, в исследованиях на животных моделях окись углерода уменьшала тяжесть экспериментально индуцированных бактериальных заболеваний. сепсис, панкреатит, ишемия / реперфузионное повреждение печени, колит, остеоартрит, повреждение легких, отторжение трансплантации легкого и невропатическая боль, способствующая заживлению кожных ран. Эти действия аналогичны действиям Специализированные посредники по разрешению споров которые действуют, чтобы смягчить, обратить вспять и восстановить повреждение тканей из-за различных воспалительных реакций. Действительно, окись углерода может действовать аддитивно с одним из этих медиаторов (Резолвин D1) для ограничения воспалительных реакций. Исследования предполагают, что оксид углерода является физиологическим фактором ограничения воспаления, и предполагают, что его доставка с помощью ингаляционных препаратов или препаратов, образующих оксид углерода, может быть терапевтически полезна для контроля патологических воспалительных реакций.[43][44][45][46]
СО действует как эндогенная сигнальная молекула, модулирует функции сердечно-сосудистой системы, ингибирует агрегацию и адгезию тромбоцитов, подавляет, реверсирует и восстанавливает повреждения, вызванные воспалительными реакциями. Он может играть роль потенциального терапевтического агента.[43][47]
Микробиология
Окись углерода является питательным веществом для метаногенный archaea, которая восстанавливает его до метана с помощью водорода.[48] Это тема для развивающейся области биоорганометаллическая химия. Таким образом, экстремофильные микроорганизмы могут утилизировать окись углерода в таких местах, как термальные источники вулканов.[49]
Некоторые микробы могут преобразовывать окись углерода в двуокись углерода для получения энергии.[50]
У бактерий окись углерода образуется через снижение диоксида углерода ферментом угарный газ дегидрогеназа, Fe -Ni -S -содержащий белок.[51]
CooA - это белок-сенсор окиси углерода.[52] Объем его биологической роли до сих пор неизвестен; он может быть частью сигнального пути у бактерий и архей. Встречаемость у млекопитающих не установлена.
Вхождение
Окись углерода встречается в различных природных и искусственных средах. Типичные концентрации в частей на миллион являются следующими:
| ppmv: частей на миллион по объему (примечание: объемная доля равно мольная доля только для идеального газа см. объем (термодинамика) ) | |
| Концентрация | Источник |
|---|---|
| 0,1 частей на миллион по объему | Уровень естественной атмосферы (МОПИТТ )[55] |
| 0,5–5 частей на миллион по объему | Средний уровень в домах[56] |
| 5–15 частей на миллион по объему | Рядом с правильно настроенными газовыми плитами в домах, выброс выхлопных газов современных автомобилей[57][нужна цитата ] |
| 17 частей на миллион по объему | Атмосфера Венеры |
| 100–200 частей на миллион по объему | Выхлоп автомобилей в центральной части Мехико в 1975 году.[58] |
| 700 частей на миллион по объему | Атмосфера Марса |
| <1000 ppmv | Выхлопные газы автомобилей после проезда каталитический нейтрализатор[59] |
| 5000 частей на миллион по объему | Выхлоп от домашнего дровяного огня[60] |
| 30 000–100 000 частей на миллион | Неразбавленный теплый автомобильный выхлоп без каталитический нейтрализатор[59] |
Атмосферное присутствие

Окись углерода (CO) присутствует в небольших количествах (около 80 частей на миллиард) в Атмосфера Земли. Около половины окиси углерода в атмосфере Земли образуется в результате сжигания ископаемое топливо и биомасса (например, лес и лесные пожары ).[61] Остальное происходит в результате химических реакций с органические соединения испускается в результате деятельности человека и растений. Небольшие количества также выбрасываются из океана и в результате геологической деятельности, поскольку окись углерода растворяется в расплавленной вулканической породе при высоких температурах. давление в земных мантия.[62] Поскольку природные источники окиси углерода меняются из года в год, трудно точно измерить естественные выбросы газа.
Окись углерода косвенно влияет на радиационное воздействие за счет повышения концентрации прямого парниковые газы, включая метан и тропосферный озон. CO может химически реагировать с другими компонентами атмосферы (в первую очередь с гидроксил радикальный, ОЙ.), который иначе разрушил бы метан.[63] В результате естественных процессов в атмосфере он окисляется до углекислый газ и озон. Окись углерода недолговечна в атмосфере (средняя продолжительность жизни составляет от одного до двух месяцев), и ее концентрация может изменяться в пространстве.[64]
в атмосфера Венеры Окись углерода возникает в результате фотодиссоциации углекислого газа электромагнитным излучением с длинами волн короче 169 нм.
В связи с длительным сроком службы в средней тропосфере окись углерода также используется в качестве индикатора выбросов загрязняющих шлейфов.[65]
Городское загрязнение
Окись углерода является временным загрязнителем атмосферы в некоторых городских районах, главным образом из-за выхлопных газов двигателей внутреннего сгорания (включая автомобили, переносные и резервные генераторы, газонокосилки, моечные машины и т. Д.), Но также в результате неполного сгорания различных других видов топлива ( включая древесину, уголь, древесный уголь, масло, парафин, пропан, природный газ и мусор).
Крупные случаи загрязнения CO можно наблюдать из космоса над городами.[66]
Роль в образовании приземного озона
Окись углерода вместе с альдегиды, часть серии циклов химических реакций, образующих фотохимический смог. Реагирует с гидроксильным радикалом (•OH) с образованием радикального интермедиата •HOCO, который быстро переносит радикальный водород в O2 формировать пероксия радикальный (HO2•) и диоксид углерода (CO2).[67] Перокси-радикал впоследствии реагирует с оксид азота (НЕТ) формировать диоксид азота (НЕТ2) и гидроксильный радикал. НЕТ2 дает O (3P) посредством фотолиза с образованием O3 после реакции с O2.Поскольку гидроксильный радикал образуется при образовании NO2, баланс последовательности химических реакций, начинающихся с окиси углерода и ведущих к образованию озона, составляет:
- CO + 2O2 + hν → CO2 + O3
(где hν относится к фотон света, поглощенного NO2 молекула в последовательности)
Хотя создание NO2 критический шаг, ведущий к низкому уровню озон образование, это также увеличивает этот озон другим, в некоторой степени взаимоисключающим способом, уменьшая количество NO, которое доступно для реакции с озоном.[68]
Загрязнение помещений
В закрытых помещениях концентрация окиси углерода может легко возрасти до смертельного уровня. В среднем 170 человек в Соединенных Штатах ежегодно умирают от окиси углерода, производимой неавтомобильными потребительскими товарами.[69] Согласно Департамент здравоохранения Флориды, «каждый год более 500 американцев умирают от случайного воздействия окиси углерода, и тысячам других жителей США требуется неотложная медицинская помощь при несмертельном отравлении угарным газом»[70] Эти продукты включают неисправные устройства для сжигания топлива, такие как печи, плиты, водонагреватели и газ и керосин комнатные обогреватели; оборудование с приводом от двигателя, такое как переносные генераторы; камины; и древесный уголь, который сжигают в домах и других закрытых помещениях. Американская ассоциация токсикологических центров (AAPCC) сообщила о 15 769 случаях отравления угарным газом, в результате которых в 2007 году погибло 39 человек.[71] В 2005 году CPSC сообщил о 94 случаях смерти от отравления угарным газом, связанных с генераторами.[69] Известно, что 47 из этих смертей произошли во время отключения электроэнергии из-за суровой погоды, в том числе ураган Катрина.[69] Третьи умирают от окиси углерода, производимого непотребительскими товарами, такими как автомобили, оставленные работающими в пристроенных гаражах. В Центры по контролю и профилактике заболеваний По оценкам, несколько тысяч человек ежегодно обращаются в отделения неотложной помощи больниц для лечения отравления угарным газом.[72]
Биологические источники
Окись углерода производится в катаболизм гема и таким образом присутствует в крови. Нормальный уровень циркуляции в крови составляет от 0% до 3% насыщения,[73] то есть отношение количества карбоксигемоглобина к общему циркулирующему гемоглобину,[74] и выше у курильщиков. Известно, что некоторые виды морских глубоководных млекопитающих поддерживают уровень карбоксигемоглобина в пределах 5-10%.[21] Уровни окиси углерода нельзя определить с помощью медицинского осмотра. Для лабораторных исследований требуется образец крови (артериальной или венозной) и лабораторный анализ на СО-оксиметре. Кроме того, существует неинвазивный метод определения карбоксигемоглобина (SpCO) от Pulse CO-Oximetry, который прошел валидацию по сравнению с инвазивными методами.[75]
Белок сенсора окиси углерода, CooA, был охарактеризован у бактерий.
Астрономия
За пределами Земли окись углерода является второй по распространенности двухатомной молекулой в межзвездная среда, после молекулярный водород. Из-за своей асимметрии это полярная молекула производит намного ярче спектральные линии чем молекула водорода, что значительно упрощает обнаружение CO. Межзвездный CO был впервые обнаружен с помощью радиотелескопы в 1970 году. В настоящее время это наиболее часто используемый индикатор молекулярного газа в межзвездной среде галактик, поскольку молекулярный водород может быть обнаружен только с помощью ультрафиолетового света, что требует космические телескопы. Наблюдения за угарным газом предоставляют большую часть информации о молекулярные облака в котором большинство форма звезд.[76]
Beta Pictoris, второй по яркости звезда в созвездие Pictor, показывает превышение инфракрасного излучения по сравнению с обычными звездами этого типа, что вызвано большим количеством пыли и газа (включая оксид углерода)[77][78] возле звезды.
Твердая окись углерода входит в состав кометы.[79] Комета Галлея составляет около 15% окиси углерода.[80] Также была выявлена спектроскопия на поверхности спутника Нептуна. Тритон.[81] При комнатной температуре и атмосферном давлении окись углерода фактически только метастабильна (см. Реакция Будуара ), и то же самое верно при низких температурах, когда CO и CO
2 твердые, но тем не менее могут существовать в кометах миллиарды лет. В атмосфере очень мало CO. Плутон, который, по всей видимости, образовался из комет. Это может быть связано с тем, что внутри Плутона есть (или была) жидкая вода. Окись углерода может реагировать с водой с образованием двуокиси углерода и водорода:
- CO + H2O → ЧАС
2 + CO
2
Это называется реакция конверсии водяного газа когда происходит в газовой фазе, но это также может происходить (очень медленно) в водном растворе. Если парциальное давление водорода достаточно высокое (например, в подземном море), муравьиная кислота будут сформированы:
- CO + H2O → HCOOH
Эти реакции могут происходить через несколько миллионов лет даже при таких температурах, как на Плутоне.[82]
Добыча полезных ископаемых
Шахтеры называют угарный газ «белой сыростью» или «тихим убийцей». Его можно найти в замкнутых пространствах с плохой вентиляцией как в открытых, так и в подземных выработках. Наиболее распространенными источниками окиси углерода при добыче полезных ископаемых являются двигатель внутреннего сгорания и взрывчатые вещества, однако на угольных шахтах окись углерода также может быть обнаружена из-за низкотемпературного окисления угля.[83]
Производство
Для производства окиси углерода разработано много методов.[84]
Промышленное производство
Основным промышленным источником CO является производитель газа, смесь, содержащая в основном монооксид углерода и азот, образовавшаяся в результате сгорания углерода на воздухе при высокой температуре, когда имеется избыток углерода. В духовке воздух проходит через слой кокс. Первоначально произведенный CO2 уравновешивается с оставшимся горячим углеродом с образованием CO. Реакция CO2 с углеродом с образованием CO описывается как Реакция Будуара.[85] При температуре выше 800 ° C преобладает CO:
- CO2 + C → 2 CO (ΔH = 170 кДж / моль)
Другой источник "водяной газ ", смесь водород и оксид углерода, образующийся в результате эндотермической реакции пар и углерод:
- ЧАС2О + С → Н2 + CO (ΔH = +131 кДж / моль)
Другое подобное »синтез-газы "можно получить из натуральный газ и другие виды топлива.
Окись углерода также может производиться высокотемпературный электролиз диоксида углерода с ячейки твердооксидного электролизера:[86] Один метод, разработанный в DTU Energy, использует катализатор на основе оксида церия и не имеет проблем с загрязнением катализатора.[87][88]
- 2 CO2 → 2 СО + О2
Окись углерода также является побочным продуктом восстановления металла. окись руды с углеродом, в упрощенном виде показаны следующим образом:
- МО + Ц → М + СО
Окись углерода также образуется при прямом окислении углерода в ограниченном количестве кислорода или воздуха.
- 2 C (т) + O2 → 2 CO (г)
Поскольку CO представляет собой газ, процесс восстановления может осуществляться путем нагрева, используя положительный (благоприятный) энтропия реакции. В Диаграмма Эллингема показывает, что образование CO предпочтительнее, чем CO2 при высоких температурах.
Лабораторная подготовка
Окись углерода удобно производить в лаборатории обезвоживание из муравьиная кислота или же Щавелевая кислота, например с концентрированным серная кислота.[89][90][91] Другой метод - нагревание интимной смеси порошкообразных цинк металл и карбонат кальция, который высвобождает CO и оставляет позади оксид цинка и оксид кальция:
- Zn + CaCO3 → ZnO + CaO + CO
Нитрат серебра и йодоформ также дают окись углерода:
- CHI3 + 3AgNO3 + H2O → 3HNO3 + CO + 3AgI
Наконец, металл оксалат соли выделяют CO при нагревании, оставляя карбонат как побочный продукт:
- Na
2C
2О
4 → Na
2CO
3 + CO
Координационная химия
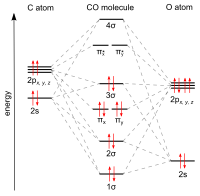
Большинство металлов образуют координационные комплексы содержащие ковалентно присоединенный окись углерода. Только металлы в более низких степенях окисления могут образовывать комплекс с монооксидом углерода. лиганды. Это потому, что должна быть достаточная электронная плотность для облегчения возвратное пожертвование из металла dxz-орбитальной, к π * молекулярная орбиталь из CO. Неподеленная пара на атоме углерода в CO также отдает электронную плотность dx² − y² на металле, чтобы сформировать сигма-облигация. Это донорство электронов также демонстрируется цис-эффект, или лабилизация лигандов CO в цис-положении. Карбонил никеля, например, образуется за счет прямого сочетания окиси углерода и никель металл:
- Ni + 4 CO → Ni (CO)4 (1 бар, 55 ° C)
По этой причине никель в любых трубках или деталях не должен вступать в продолжительный контакт с оксидом углерода. Карбонил никеля легко разлагается обратно на Ni и CO при контакте с горячими поверхностями, и этот метод используется для промышленной очистки никель в Мондовский процесс.[92]
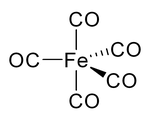
В карбониле никеля и других карбонилах электронная пара на углероде взаимодействует с металлом; монооксид углерода отдает металлу электронную пару. В этих ситуациях окись углерода называется карбонил лиганд. Одним из наиболее важных карбонилов металлов является пентакарбонил железа, Fe (CO)5:

Многие комплексы металл-CO получают декарбонилированием органических растворителей, а не CO. Например, трихлорид иридия и трифенилфосфин реагировать при кипении 2-метоксиэтанол или же DMF позволить себе IrCl (CO) (PPh3)2.
Карбонилы металлов в координационной химии обычно изучают с помощью ИК-спектроскопия.
Органическая химия и химия основных групп
В присутствии сильных кислот и воды окись углерода реагирует с алкены формировать карбоновые кислоты в процессе, известном как реакция Коха – Хафа.[89] в Реакция Гаттермана – Коха, арены преобразованы в бензальдегид производные в присутствии AlCl3 и HCl.[90] Литийорганические соединения (например, бутиллитий ) реагируют с монооксидом углерода, но эти реакции имеют мало научного применения.
Хотя CO реагирует с карбокатионы и карбанионы, он относительно инертен по отношению к органическим соединениям без вмешательства металлических катализаторов.[93]
С реагентами основной группы CO претерпевает несколько заслуживающих внимания реакций. Хлорирование CO - это промышленный путь к важному соединению фосген. С боран СО образует аддукт ЧАС3BCO, который изоэлектронный с ацетилий катион [H3CCO]+. CO реагирует с натрий чтобы получить продукты, полученные в результате сочетания C-C, такие как ацетилендиолат натрия 2Na+
·C
2О2−
2. Реагирует с расплавленным калий чтобы получить смесь металлоорганического соединения, ацетилендиолат калия 2K+
·C
2О2−
2, бензолгексолат калия 6K+
C
6О6−
6,[94] и родизонат калия 2K+
·C
6О2−
6.[95]
Соединения циклогексангексон или трихиноил (C6О6) и циклопентанепентон или лейконовая кислота (C5О5), которые пока получены лишь в следовых количествах, можно рассматривать как полимеры монооксида углерода.
При давлении более 5 гигапаскали, окись углерода превращается в твердый полимер углерода и кислорода. Это метастабильно при атмосферном давлении, но является мощным взрывчатым веществом.[96][97]
Использует
Химическая индустрия
Окись углерода - это промышленный газ который имеет множество применений в производстве сыпучих химикатов.[98] Большое количество альдегидов производится гидроформилирование реакция алкены, оксид углерода и H2. Гидроформилирование сопряжено с Процесс производства высших олефинов Shell дать предшественников моющие средства.
Фосген, полезный для получения изоцианатов, поликарбонатов и полиуретанов, производится пропусканием очищенного монооксида углерода и хлор газ через слой пористой Активированный уголь, который служит катализатор. Мировое производство этого соединения в 1989 году оценивалось в 2,74 миллиона тонн.[99]
- CO + Cl2 → COCl2
Метанол производится гидрирование окиси углерода. В родственной реакции гидрирование окиси углерода связано с образованием связи C-C, как в Процесс Фишера-Тропша где окись углерода гидрируется до жидкого углеводородного топлива. Эта технология позволяет каменный уголь или биомасса для преобразования в дизельное топливо.
в Cativa процесс, окись углерода и метанол реагируют в присутствии однородного Иридий катализатор и йодистоводородная кислота давать уксусная кислота. Этот процесс отвечает за большую часть промышленного производства уксусная кислота.
Чистый окись углерода используется в промышленных масштабах для очистки никель в Мондовский процесс.
Окись углерода также может использоваться в реакция конверсии водяного газа производить водород.
Мясная окраска
Окись углерода используется в модифицированная атмосфера системы упаковки в США, в основном для свежих мясных продуктов, таких как говядина, свинина и рыба, чтобы они оставались свежими. Окись углерода соединяется с миоглобин с образованием карбоксимиоглобина, ярко-вишнево-красного пигмента. Карбоксимиоглобин более стабилен, чем кислородсодержащая форма миоглобина, оксимиоглобин, который может окисляться до коричневого пигмента. метмиоглобин. Этот стабильный красный цвет может сохраняться намного дольше, чем у мяса в обычной упаковке.[100] Типичные уровни окиси углерода, используемые на предприятиях, использующих этот процесс, составляют от 0,4% до 0,5%.
Технология была впервые дана "общепризнанно безопасным "(ГРАС) статус по Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2002 году для использования в качестве системы вторичной упаковки и не требует маркировки. В 2004 году FDA одобрило CO в качестве метода первичной упаковки, заявив, что CO не маскирует запах порчи.[101] Несмотря на это решение, этот процесс остается спорным из-за опасений, что он скрывает порчу.[102] В 2007 году вексель[103] был представлен Палата представителей США маркировать упаковку с оксидом углерода в модифицированной атмосфере как красящую добавку, но законопроект умер в подкомитете. Процесс запрещен во многих других странах, включая Японию, Сингапур, а Евросоюз.[104][105][106]
Лекарство
В биологии оксид углерода естественным образом образуется под действием гемоксигеназа 1 и 2 на гем из гемоглобин авария. Этот процесс производит определенное количество карбоксигемоглобина у нормальных людей, даже если они не дышат угарным газом.
После первого сообщения о том, что окись углерода является нормальным нейромедиатором в 1993 году,[17][18] а также один из трех газов, которые естественным образом модулируют воспалительные реакции в организме (два других - оксид азота и сероводород ), монооксид углерода получил большое клиническое внимание как биологический регулятор. Известно, что во многих тканях все три газа действуют как противовоспалительные, вазодилататоры, и вдохновители неоваскулярный рост.[19] Однако проблемы являются сложными, поскольку неоваскулярный рост не всегда полезен, поскольку он играет роль в росте опухоли, а также в ущербе от смачивать дегенерация желтого пятна, заболевание, при котором курение (основной источник окиси углерода в крови, в несколько раз превышающий естественный уровень производства) увеличивает риск от 4 до 6 раз.
Есть теория, что в какой-то нервной клетке синапсы, когда долгосрочные воспоминания При укладке, принимающая ячейка вырабатывает окись углерода, которая возвращается обратно в передающую ячейку, заставляя ее передавать более легко в будущем. Было показано, что некоторые такие нервные клетки содержат гуанилатциклаза, фермент который активируется оксидом углерода.[18]
Исследования с участием окиси углерода были проведены во многих лабораториях по всему миру на предмет его противовоспалительных и цитопротекторных свойств. Эти свойства могут быть использованы для предотвращения развития ряда патологических состояний, включая ишемическое реперфузионное повреждение, отторжение трансплантата, атеросклероз, тяжелый сепсис, тяжелую малярию или аутоиммунитет. Были проведены клинические испытания с участием людей, однако результаты еще не опубликованы.[20]
Металлургия
Окись углерода является сильным восстанавливающим агентом и, хотя и неизвестно, использовалась в пирометаллургия уменьшить металлы из руды с древних времен. Оксид углерода удаляет кислород из оксидов металлов, восстанавливая их до чистого металла при высоких температурах, образуя углекислый газ в процессе. Окись углерода обычно не подается в реактор в газовой фазе как есть, а скорее образуется при высокой температуре в присутствии кислородсодержащей руды или углеродсодержащего агента, такого как кокс, и при высокой температуре. В доменная печь Процесс является типичным примером процесса восстановления металла из руды монооксидом углерода.
Лазеры
Окись углерода также использовалась в качестве лазерная среда в мощном инфракрасном лазеры.[107]
Ниша использует
Окись углерода была предложена для использования в качестве топлива на Марсе. Двигатели с угарным газом / кислородом были предложены для использования на ранних этапах наземного транспорта, поскольку и оксид углерода, и кислород могут быть легко получены из диоксида углерода. атмосфера Марса к цирконий электролиз, без использования каких-либо Марсианские водные ресурсы для получения водорода, который понадобится для производства метана или любого водородного топлива.[108] Так же, доменный газ собирается в верхней части доменной печи, все еще содержит от 10% до 30% окиси углерода и используется в качестве топлива на Кауперные печи и на печах Сименс-Мартин на мартеновское производство стали.
Смотрите также
- Окись углерода (страница данных) - Страница химических данных
- Окись углерода дыхания
- Детектор угарного газа - Устройство для измерения угарного газа (CO)
- Критерии загрязнителей воздуха
- Список высокотоксичных газов - Статья со списком Википедии
- Общество подводной и гипербарической медицины - Американская организация исследований и образования в области гипербарической физиологии и медицины. - гипербарическое лечение отравления СО
- Фонд Рубикон - Некоммерческая организация для содействия исследованиям и доступу к информации о подводных погружениях, исследовательских статьях об отравлении угарным газом.
Рекомендации
- ^ а б "Монооксид углерода". Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Ричард, Поханиш (2012). Справочник Ситтига по токсичным и опасным химическим веществам и канцерогенам (2-е изд.). Эльзевир. п. 572. ISBN 978-1-4377-7869-4. Получено 5 сентября 2015.
- ^ Карманный справочник NIOSH по химической опасности. "#0105". Национальный институт охраны труда и здоровья (NIOSH).
- ^ GOV, Управление реагирования и восстановления NOAA, США. «ОКИСЬ УГЛЕРОДА - CAMEO Chemicals - NOAA». cameochemicals.noaa.gov.
- ^ Пенни, Дэвид Г. (2000) Токсичность окиси углерода, CRC Press, стр. 5, ISBN 0-8493-2065-8.
- ^ Крукшанк, В. (1801) "Some observations on different hydrocarbons and combinations of carbon with oxygen, etc. in reply to some of Dr. Priestley's late objections to the new system of chemistry," Journal of Natural Philosophy, Chemistry and the Arts [a.k.a. Nicholson's Journal], 1st series, 5 : 1–9.
- ^ Cruickshank, W. (1801) "Some additional observations on hydrocarbons, and the gaseous oxide of carbon," Journal of Natural Philosophy, Chemistry and the Arts, 1st series, 5 : 201–211.
- ^ Waring, Rosemary H.; Steventon, Glyn B.; Mitchell, Steve C. (2007). Molecules of death. Imperial College Press. п. 38. ISBN 978-1-86094-814-5.
- ^ Kitchen, Martin (2006). A history of modern Germany, 1800–2000. Вили-Блэквелл. п. 323. ISBN 978-1-4051-0041-0.
- ^ Thompson, Mike. Carbon Monoxide – Molecule of the Month, Winchester College, UK.
- ^ Эйрес, Роберт У .; Ayres, Edward H. (2009). Crossing the Energy Divide: Moving from Fossil Fuel Dependence to a Clean-Energy Future. Wharton School Publishing. п. 36. ISBN 978-0-13-701544-3.
- ^ Кинетические исследования окисления пропана на смешанных оксидных катализаторах на основе Mo и V (PDF). 2011.
- ^ Амакава, Кадзухико; Коленько, Юрий В .; Вилла, Альберто; Шустер, Манфред Э /; Чепеи, Ленард-Иштван; Вайнберг, Гизела; Врабец, Сабина; Науманн д'Алнонкур, Рауль; Girgsdies, Франк; Прати, Лаура; Шлёгль, Роберт; Trunschke, Annette (26 April 2013). «Многофункциональность кристаллических оксидных катализаторов MoV (TeNb) M1 в селективном окислении пропана и бензилового спирта». Катализ ACS. 3 (6): 1103–1113. Дои:10.1021 / cs400010q.
- ^ Науманн д'Алнонкур, Рауль; Чепеи, Ленард-Иштван; Хэвекер, Майкл; Girgsdies, Франк; Schuster, Manfred E .; Шлёгль, Роберт; Trunschke, Annette (March 2014). «Реакционная сеть при окислении пропана на фазово-чистых оксидных катализаторах MoVTeNb M1» (PDF). Журнал катализа. 311: 369–385. Дои:10.1016 / j.jcat.2013.12.008. HDL:11858 / 00-001M-0000-0014-F434-5. Архивировано из оригинал (PDF) на 2016-02-15. Получено 2018-04-14.
- ^ Хэвекер, Майкл; Врабец, Сабина; Крёнерт, Ютта; Чепеи, Ленард-Иштван; Науманн д'Алнонкур, Рауль; Коленько, Юрий В .; Girgsdies, Франк; Шлёгль, Роберт; Trunschke, Annette (January 2012). «Химия поверхности фазово-чистого оксида M1 MoVTeNb при работе с селективным окислением пропана до акриловой кислоты» (PDF). Журнал катализа. 285 (1): 48–60. Дои:10.1016 / j.jcat.2011.09.012. HDL:11858 / 00-001M-0000-0012-1BEB-F. Архивировано из оригинал (PDF) на 2016-10-30. Получено 2018-04-14.
- ^ Weinstock, B.; Niki, H. (1972). "Carbon Monoxide Balance in Nature". Наука. 176 (4032): 290–2. Bibcode:1972Sci...176..290W. Дои:10.1126/science.176.4032.290. PMID 5019781. S2CID 25223868.
- ^ а б Верма, А; Hirsch, D.; Glatt, C.; Ronnett, G.; Snyder, S. (1993). "Carbon monoxide: A putative neural messenger". Наука. 259 (5093): 381–4. Bibcode:1993Sci...259..381V. Дои:10.1126/science.7678352. PMID 7678352.
- ^ а б c Kolata, Gina (January 26, 1993). "Carbon Monoxide Gas Is Used by Brain Cells As a Neurotransmitter". Нью-Йорк Таймс. Получено 2 мая, 2010.
- ^ а б Ли, Л; Hsu, A; Moore, PK (2009). "Actions and interactions of nitric oxide, carbon monoxide and hydrogen sulphide in the cardiovascular system and in inflammation—a tale of three gases!". Фармакология и терапия. 123 (3): 386–400. Дои:10.1016/j.pharmthera.2009.05.005. PMID 19486912.
- ^ а б Johnson, Carolyn Y. (October 16, 2009). "Poison gas may carry a medical benefit". Бостонский глобус. Получено 16 октября, 2009.
- ^ а б Tift, M; Ponganis, P; Crocker, D (2014). "Elevated carboxyhemoglobin in a marine mammal, the northern elephant seal". Журнал экспериментальной биологии. 217 (10): 1752–1757. Дои:10.1242/jeb.100677. ЧВК 4020943. PMID 24829326.
- ^ Tift, M; Ponganis, P (2019). "Time Domains of Hypoxia Adaptation-Elephant Seals Stand Out Among Divers". Границы физиологии. 10: 677. Дои:10.3389/fphys.2019.00677. ЧВК 6558045. PMID 31214049.
- ^ Gilliam, O. R.; Johnson, C. M.; Горди, В. (1950). "Microwave Spectroscopy in the Region from Two to Three Millimeters". Физический обзор. 78 (2): 140–144. Bibcode:1950PhRv...78..140G. Дои:10.1103/PhysRev.78.140.
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 изд.). Boca Raton, Florida, USA: CRC Press. п. 9–33. ISBN 978-1-43982077-3.
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 изд.). Boca Raton, Florida, USA: CRC Press. п. 9–39. ISBN 978-1-43982077-3.
- ^ Common Bond Energies (D) and Bond Lengths (r). wiredchemist.com
- ^ Vidal, C. R. (28 June 1997). "Highly Excited Triplet States of Carbon Monoxide". Архивировано из оригинал на 2006-08-28. Получено 16 августа, 2012.
- ^ Scuseria, Gustavo E.; Миллер, Майкл Д .; Jensen, Frank; Geertsen, Jan (1991). "The dipole moment of carbon monoxide". J. Chem. Phys. 94 (10): 6660. Bibcode:1991JChPh..94.6660S. Дои:10.1063/1.460293.
- ^ Martinie, Ryan J.; Bultema, Jarred J.; Vander Wal, Mark N.; Burkhart, Brandon J.; Vander Griend, Douglas A.; DeKock, Roger L. (2011-08-01). "Bond Order and Chemical Properties of BF, CO, and N2". Журнал химического образования. 88 (8): 1094–1097. Bibcode:2011JChEd..88.1094M. Дои:10.1021/ed100758t. ISSN 0021-9584. S2CID 11905354.
- ^ 1925-, Ulrich, Henri (2009). Cumulenes in click reactions. Wiley InterScience (Online service). Chichester, U.K.: Wiley. п. 45. ISBN 9780470747957. OCLC 476311784.CS1 maint: числовые имена: список авторов (связь)
- ^ Lupinetti, Anthony J.; Fau, Stefan; Frenking, Gernot; Strauss, Steven H. (1997). "Theoretical Analysis of the Bonding between CO and Positively Charged Atoms". J. Phys. Chem. А. 101 (49): 9551–9559. Bibcode:1997JPCA..101.9551L. Дои:10.1021/jp972657l.
- ^ Blanco, Fernando; Alkorta, Ibon; Solimannejad, Mohammad; Elguero, Jose (2009). "Theoretical Study of the 1:1 Complexes between Carbon Monoxide and Hypohalous Acids". J. Phys. Chem. А. 113 (13): 3237–3244. Bibcode:2009JPCA..113.3237B. Дои:10.1021/jp810462h. HDL:10261/66300. PMID 19275137.
- ^ Meerts, W; De Leeuw, F.H.; Dymanus, A. (1 June 1977). "Electric and magnetic properties of carbon monoxide by molecular-beam electric-resonance spectroscopy". Химическая физика. 22 (2): 319–324. Bibcode:1977CP.....22..319M. Дои:10.1016/0301-0104(77)87016-X.
- ^ Stefan, Thorsten; Janoschek, Rudolf (2000). "How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2ТАК3, H2ТАК4, and H3PO3, respectively?". Journal of Molecular Modeling. 6 (2): 282–288. Дои:10.1007/PL00010730. S2CID 96291857.
- ^ Omaye ST (2002). "Metabolic modulation of carbon monoxide toxicity". Токсикология. 180 (2): 139–150. Дои:10.1016/S0300-483X(02)00387-6. PMID 12324190.
- ^ Tikuisis, P; Kane, DM; McLellan, TM; Buick, F; Fairburn, SM (1992). "Rate of formation of carboxyhemoglobin in exercising humans exposed to carbon monoxide". Журнал прикладной физиологии. 72 (4): 1311–9. Дои:10.1152/jappl.1992.72.4.1311. PMID 1592720.
- ^ "OSHA CO guidelines". OSHA. Архивировано из оригинал on January 26, 2010. Получено 27 мая, 2009.
- ^ а б Blumenthal, Ivan (1 June 2001). "Отравление угарным газом". J R Soc Med. 94 (6): 270–272. Дои:10.1177/014107680109400604. ЧВК 1281520. PMID 11387414.
- ^ Ganong, William F (2005). "37". Review of medical physiology (22-е изд.). Макгроу-Хилл. п. 684. ISBN 978-0-07-144040-0. Получено 27 мая, 2009.
- ^ Prockop LD, Chichkova RI (2007). "Carbon monoxide intoxication: an updated review". J Neurol Sci. 262 (1–2): 122–130. Дои:10.1016/j.jns.2007.06.037. PMID 17720201. S2CID 23892477.
- ^ Tucker Blackburn, Susan (2007). Maternal, fetal, & neonatal physiology: a clinical perspective. Elsevier Health Sciences. п. 325. ISBN 978-1-4160-2944-1.
- ^ а б Wu, L; Wang, R (December 2005). "Carbon Monoxide: Endogenous Production, Physiological Functions, and Pharmacological Applications". Pharmacol Rev. 57 (4): 585–630. Дои:10.1124/pr.57.4.3. PMID 16382109. S2CID 17538129.
- ^ а б Wallace JL, Ianaro A, Flannigan KL, Cirino G (2015). "Gaseous mediators in resolution of inflammation". Семинары по иммунологии. 27 (3): 227–33. Дои:10.1016/j.smim.2015.05.004. PMID 26095908.
- ^ Uehara EU, Shida Bde S, de Brito CA (2015). "Role of nitric oxide in immune responses against viruses: beyond microbicidal activity". Исследование воспаления. 64 (11): 845–52. Дои:10.1007/s00011-015-0857-2. PMID 26208702. S2CID 14587150.
- ^ Nakahira K, Choi AM (2015). "Carbon monoxide in the treatment of sepsis". Американский журнал физиологии. Клеточная и молекулярная физиология легких. 309 (12): L1387–93. Дои:10.1152/ajplung.00311.2015. ЧВК 4683310. PMID 26498251.
- ^ Shinohara M, Serhan CN (2016). "Novel Endogenous Proresolving Molecules:Essential Fatty Acid-Derived and Gaseous Mediators in the Resolution of Inflammation". Journal of Atherosclerosis and Thrombosis. 23 (6): 655–64. Дои:10.5551/jat.33928. ЧВК 7399282. PMID 27052783.
- ^ Olas, Beata (25 April 2014). "Carbon monoxide is not always a poison gas for human organism: Physiological and pharmacological features of CO". Химико-биологические взаимодействия. 222 (5 October 2014): 37–43. Дои:10.1016/j.cbi.2014.08.005. PMID 25168849.
- ^ Тауер, Р. К. (1998). "Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture" (Свободный). Микробиология. 144 (9): 2377–2406. Дои:10.1099/00221287-144-9-2377. PMID 9782487.
- ^ Hogan, C. Michael (2010). "Extremophile" in E. Monosson and C. Cleveland (eds.). Энциклопедия Земли. National Council for Science and the Environment, Washington, DC
- ^ "Martian life must be rare as free energy source remains untapped". Новый ученый. 13 мая 2017 года.
- ^ Jaouen, G., ed. (2006). Биоорганометаллические вещества: биомолекулы, маркировка, медицина. Вайнхайм: Wiley-VCH. ISBN 978-3-527-30990-0.
- ^ Roberts, G. P.; Youn, H.; Kerby, R. L. (2004). "CO-Sensing Mechanisms". Обзоры микробиологии и молекулярной биологии. 68 (3): 453–473. Дои:10.1128/MMBR.68.3.453-473.2004. ЧВК 515253. PMID 15353565.
- ^ Global Maps. Монооксид углерода. earthobservatory.nasa.gov
- ^ Source for figures: Carbon dioxide, Лаборатория исследования системы Земля NOAA, (updated 2010.06). Methane, IPCC TAR table 6.1, (updated to 1998). The NASA total was 17 ppmv over 100%, and CO2 was increased here by 15 ppmv. To normalize, N2 should be reduced by about 25 ppmv and O2 by about 7 ppmv.
- ^ Committee on Medical and Biological Effects of Environmental Pollutants (1977). Монооксид углерода. Вашингтон, округ Колумбия: Национальная академия наук. п. 29. ISBN 978-0-309-02631-4.
- ^ Green W. "An Introduction to Indoor Air Quality: Carbon Monoxide (CO)". Агентство по охране окружающей среды США. Получено 2008-12-16.
- ^ Gosink, Tom (1983-01-28). "What Do Carbon Monoxide Levels Mean?". Alaska Science Forum. Geophysical Institute, University of Alaska Fairbanks. Архивировано из оригинал на 2008-12-25. Получено 2007-12-01.
- ^ Singer, Siegfried Fred (1975). The Changing Global Environment. Springer. п. 90. ISBN 978-9027704023.
- ^ а б "Carbon Monoxide Poisoning: Vehicles (AEN-208)". abe.iastate.edu. Получено 11 февраля 2018.
- ^ Gosink T (January 28, 1983). "What Do Carbon Monoxide Levels Mean?". Alaska Science Forum. Geophysical Institute, University of Alaska Fairbanks. Архивировано из оригинал 25 декабря 2008 г.. Получено 16 декабря, 2008.
- ^ Seinfeld, John; Pandis, Spyros (2006). Atmospheric Chemistry and Physics: From Air Pollution to Climate Change. Джон Вили и сыновья. ISBN 978-0-471-72018-8.
- ^ Сигель, Астрид; Sigel, Roland K. O. (2009). Metal-Carbon Bonds in Enzymes and Cofactors. Королевское химическое общество. п. 243. ISBN 978-1-84755-915-9.
- ^ White, James Carrick; и другие. (1989). Global climate change linkages: acid rain, air quality, and stratospheric ozone. Springer. п. 106. ISBN 978-0-444-01515-0.
- ^ Drummond, James (February 2, 2018). "MOPITT, Atmospheric Pollution, and Me: A Personal Story". Канадское метеорологическое и океанографическое общество. Получено 1 августа, 2018.
- ^ Pommier, M.; Law, K. S.; Clerbaux, C.; Turquety, S.; Hurtmans, D.; Hadji-Lazaro, J.; Coheur, P.-F.; Schlager, H .; Ancellet, G.; Paris, J.-D.; Nédélec, P.; Diskin, G. S.; Podolske, J. R.; Holloway, J. S.; Bernath, P. (2010). "IASI carbon monoxide validation over the Arctic during POLARCAT spring and summer campaigns". Атмосферная химия и физика. 10 (21): 10655–10678. Bibcode:2010ACP....1010655P. Дои:10.5194/acp-10-10655-2010.
- ^ Pommier, M.; McLinden, C. A.; Deeter, M. (2013). "Relative changes in CO emissions over megacities based on observations from space". Письма о геофизических исследованиях. 40 (14): 3766. Bibcode:2013GeoRL..40.3766P. Дои:10.1002/grl.50704.
- ^ Ривз, Клэр Э .; Penkett, Stuart A.; Bauguitte, Stephane; Law, Kathy S.; Evans, Mathew J.; Bandy, Brian J.; Monks, Paul S.; Edwards, Gavin D.; Phillips, Gavin; Barjat, Hannah; Kent, Joss; Dewey, Ken; Schmitgen, Sandra; Kley, Dieter (2002). "Potential for photochemical ozone formation in the troposphere over the North Atlantic as derived from aircraft observationsduring ACSOE". Журнал геофизических исследований. 107 (D23): 4707. Bibcode:2002JGRD..107.4707R. Дои:10.1029/2002JD002415.
- ^ Ozone and other photochemical oxidants. Национальные академии. 1977. с. 23. ISBN 978-0-309-02531-7.
- ^ а б c Комиссия США по безопасности потребительских товаров, Carbon Monoxide Questions and Answers В архиве 2010-01-09 на Wayback Machine, accessed 2009-12-04
- ^ "Tracking Carbon Monoxide". Environmental Public Health Tracking – Florida Dept. of Health. Архивировано из оригинал on 2011-09-27.
- ^ "AAPCC Annual Data Reports 2007". American Association of Poison Control Centers.
- ^ Centers for Disease Control and Prevention, National Environmental Public Health Tracking Network, Отравление угарным газом, accessed 2009-12-04
- ^ "Carbon Monoxide (Blood) - Health Encyclopedia - University of Rochester Medical Center". urmc.rochester.edu.
- ^ Engel, Rolf R.; Rodkey, F. Lee; Krill, Carl E. (April 1, 1971). "Carboxyhemoglobin Levels as an Index of Hemolysis". Педиатрия. 47 (4): 723–730. PMID 5104458 – via pediatrics.aappublications.org.
- ^ Roth D.; Herkner H.; Schreiber W.; Hubmann N.; Gamper G.; Laggner A.N.; Havel C. (2011). "Accuracy of Noninvasive Multiwave Pulse Oximetry Compared With Carboxyhemoglobin From Blood Gas Analysis in Unselected Emergency Department Patients" (PDF). Анналы неотложной медицины. 58 (1): 74–9. Дои:10.1016/j.annemergmed.2010.12.024. PMID 21459480.
- ^ Combes, Françoise (1991). "Distribution of CO in the Milky Way". Ежегодный обзор астрономии и астрофизики. 29: 195–237. Bibcode:1991ARA&A..29..195C. Дои:10.1146/annurev.aa.29.090191.001211.
- ^ Khan, Amina. "Did two planets around nearby star collide? Toxic gas holds hints". Лос-Анджелес Таймс. Получено 9 марта, 2014.
- ^ Dent, W.R.F.; Wyatt, M.C.;Roberge, A.; Augereau, J.-C.; Casassus, S.;Corder, S.; Greaves, J.S.; de Gregorio-Monsalvo, I; Hales, A.; Jackson, A.P.; Хьюз, А. Мередит; Lagrange, A.-M; Matthews, B .; Wilner, D. (March 6, 2014). "Molecular Gas Clumps from the Destruction of Icy Bodies in the β Pictoris Debris Disk". Наука. 343 (6178): 1490–1492. arXiv:1404.1380. Bibcode:2014Sci...343.1490D. Дои:10.1126/science.1248726. PMID 24603151. S2CID 206553853. Получено 9 марта, 2014.CS1 maint: использует параметр авторов (связь)
- ^ Greenberg, J. Mayo (1998). "Making a comet nucleus". Астрономия и астрофизика. 330: 375. Bibcode:1998A&A...330..375G.
- ^ Yeomans, Donald K. (2005). "Comets (World Book Online Reference Center 125580)". НАСА. Архивировано из оригинал 29 апреля 2005 г.. Получено 20 ноября 2007.
- ^ Lellouch, E .; de Bergh, C.; Sicardy, B.; Ferron, S.; Käufl, H.-U. (2010). "Detection of CO in Triton's atmosphere and the nature of surface-atmosphere interactions". Астрономия и астрофизика. 512: L8. arXiv:1003.2866. Bibcode:2010A&A...512L...8L. Дои:10.1051/0004-6361/201014339. ISSN 0004-6361. S2CID 58889896.
- ^ Christopher Glein and Hunter Waite (May 11, 2018). "Primordial N2 provides a cosmo chemical explanation for the existence of Sputnik Planitia, Pluto". Икар. 313: 79–92. arXiv:1805.09285. Bibcode:2018Icar..313...79G. Дои:10.1016/j.icarus.2018.05.007. S2CID 102343522.
- ^ "MSHA - Occupational Illness and Injury Prevention Program - Health Topics - Carbon Monoxide". arlweb.msha.gov. Архивировано из оригинал на 2017-12-31. Получено 2017-12-31.
- ^ Холлеман, А. Ф .; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 200. ISBN 0-12-352651-5.
- ^ Higman, C; van der Burgt, M (2003). Gasification. Gulf Professional Publishing. п.12. ISBN 978-0-7506-7707-3.
- ^ Zheng, Yun; Wang, Jianchen; Yu, Bo; Zhang, Wenqiang; Chen, Jing; Qiao, Jinli; Zhang, Jiujun (2017). "A review of high temperature co-electrolysis of H O and CO to produce sustainable fuels using solid oxide electrolysis cells (SOECs): advanced materials and technology". Chem. Soc. Rev. 46 (5): 1427–1463. Дои:10.1039/C6CS00403B. PMID 28165079.
- ^ "New route to carbon-neutral fuels from carbon dioxide discovered by Stanford-DTU team - DTU". dtu.dk.
- ^ Skafte, Theis L.; Guan, Zixuan; Machala, Michael L.; Gopal, Chirranjeevi B.; Monti, Matteo; Martinez, Lev; Stamate, Eugen; Sanna, Simone; Garrido Torres, Jose A.; Crumlin, Ethan J.; García-Melchor, Max; Bajdich, Michal; Chueh, William C.; Graves, Christopher (October 8, 2019). "Selective high-temperature CO 2 electrolysis enabled by oxidized carbon intermediates". Nature Energy. 4 (10): 846–855. Дои:10.1038/s41560-019-0457-4. S2CID 202640892 - через www.nature.com.
- ^ а б Koch, H .; Хааф, В. (1973). «1-Адамантанкарбоновая кислота». Органический синтез.; Коллективный объем, 5, п. 20
- ^ а б Coleman, G. H.; Craig, David (1943). "п-Толуальдегид ». Органический синтез.; Коллективный объем, 2, п. 583
- ^ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. Нью-Йорк: Academic Press. п. 646. ISBN 978-0121266011.
- ^ Mond L, Langer K, Quincke F (1890). "Action of carbon monoxide on nickel". Журнал химического общества. 57: 749–753. Дои:10.1039/CT8905700749.
- ^ Chatani, N.; Murai, S. "Carbon Monoxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. Дои:10.1002/047084289X
- ^ Büchner, W.; Вайс, Э. (1964). "Zur Kenntnis der sogenannten "Alkalicarbonyle" IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid". Helvetica Chimica Acta. 47 (6): 1415–1423. Дои:10.1002/hlca.19640470604.
- ^ Fownes, George (1869). A Manual of elementary chemistry. H.C. Леа. п.678.
- ^ Katz, Allen I.; Schiferl, David; Mills, Robert L. (1984). "New phases and chemical reactions in solid carbon monoxide under pressure". Журнал физической химии. 88 (15): 3176–3179. Дои:10.1021/j150659a007.
- ^ Evans, W. J.; Lipp, M. J.; Yoo, C.-S.; Cynn, H.; Herberg, J. L.; Maxwell, R. S.; Nicol, M. F. (2006). "Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer". Химия материалов. 18 (10): 2520–2531. Дои:10.1021/cm0524446.
- ^ Elschenbroich, C.; Salzer, A. (2006). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH. ISBN 978-3-527-28165-7.
- ^ Вольфганг Шнайдер; Вернер Диллер. «Фосген». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_411.
- ^ Sorheim, S; Nissena, H; Nesbakken, T (1999). "The storage life of beef and pork packaged in an atmosphere with low carbon monoxide and high carbon dioxide". Journal of Meat Science. 52 (2): 157–164. Дои:10.1016/S0309-1740(98)00163-6. PMID 22062367.
- ^ Eilert EJ (2005). "New packaging technologies for the 21st century". Journal of Meat Science. 71 (1): 122–127. Дои:10.1016/j.meatsci.2005.04.003. PMID 22064057.
- ^ Huffman, Randall D. "Low-Oxygen Packaging with CO: A Study in Food Politics That Warrants Peer Review". FoodSafetyMagazine.com. Получено 18 апреля, 2007.
- ^ "Carbon Monoxide Treated Meat, Poultry, and Seafood Safe Handling, Labeling, and Consumer Protection Act (Introduced in House)". The Library of Congress. 2007-07-19.
- ^ "Proof in the Pink? Meat Treated to Give It Fresh Look". ABC News. 14 ноября 2007 г.. Получено 5 мая, 2009.
- ^ Carbon Monoxide in Meat Packaging: Myths and Facts. American Meat Institute. 2008. Архивировано с оригинал на 2011-07-14. Получено 5 мая, 2009.
- ^ "CO in packaged meat". Carbon Monoxide Kills Campaign. Архивировано из оригинал 26 сентября 2010 г.. Получено 5 мая, 2009.
- ^ Ionin, A.; Kinyaevskiy, I.; Klimachev, Y.; Kotkov, A.; Kozlov, A. (2012). "Novel mode-locked carbon monoxide laser system achieves high accuracy". Отдел новостей SPIE. Дои:10.1117/2.1201112.004016. S2CID 112510554.
- ^ Landis (2001). «Марсианский ракетный аппарат с использованием ракетного топлива in situ». Journal of Spacecraft and Rockets. 38 (5): 730–735. Bibcode:2001JSpRo..38..730L. Дои:10.2514/2.3739.
внешняя ссылка
- Global map of carbon monoxide distribution
- Explanation of the structure
- Carbon Monoxide Safety Association
- International Chemical Safety Card 0023
- CDC NIOSH Pocket Guide to Chemical Hazards: Carbon monoxide —Национальный институт охраны труда и здоровья (NIOSH), US Центры по контролю и профилактике заболеваний (CDC)
- External MSDS data sheet
- Carbon Monoxide Detector Placement
- Carbon Monoxide Purification Process
- Microscale Gas Chemistry Experiments with Carbon Monoxide
- "Instant insight: Don't blame the messenger". Химическая биология (11: Research News). 18 октября 2007 г. Архивировано с оригинал 28 октября 2007 г.. Получено 27 октября 2019. Outlining the physiology of carbon monoxide from the Королевское химическое общество.







