Фенилацетон - Phenylacetone - Wikipedia
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 1-фенилпропан-2-он | |
| Другие имена Бензилметилкетон; Метилбензилкетон; Фенил-2-пропанон | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.859 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C9ЧАС10О | |
| Молярная масса | 134.178 г · моль−1 |
| Внешность | Бесцветный, приятный запах |
| Плотность | 1,006 г / мл |
| Температура плавления | -15 ° С (5 ° F, 258 К) |
| Точка кипения | От 214 до 216 ° C (от 417 до 421 ° F, от 487 до 489 K) |
| -83.44·10−6 см3/ моль | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фенилацетон является органическое соединение с химическая формула C6ЧАС5CH2COCH3. Это бесцветное масло, растворимое в органические растворители. Этот вещество используется в производстве метамфетамин и амфетамин, где он широко известен как P2P. Из-за незаконного использования в подпольная химия, он был объявлен Список II контролируемых веществ в Соединенные Штаты в 1980 г.[1] У людей фенилацетон встречается как метаболит амфетамин и метамфетамин через FMO3 -опосредованный окислительное дезаминирование.[2][3]
Синтез
Один из способов создания фенилацетона - это:
- фенилуксусная кислота (C8ЧАС8О2) → уксусный ангидрид (C4ЧАС6О3) → пиридин катализатор → фенилацетон (C9ЧАС10О) + углекислый газ (CO2) + воды (ЧАС2O)
Ацетат натрия был использован вместо пиридина.[4][5]
В 20 веке хлорацетон, бензол, и безводный хлорид алюминия были использованы для синтеза фенилацетона.[6] Реакция включала Алкилирование Фриделя – Крафтса.
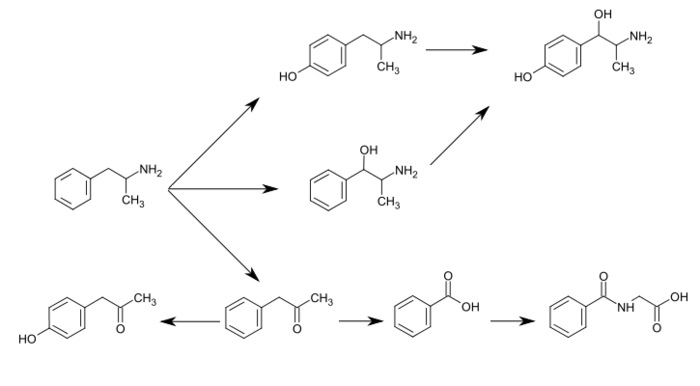
Метаболизм амфетамина
Метаболические пути амфетамина у людей[источники 1] |
В популярной культуре
В сериале Во все тяжкие, Уолтер Уайт производит метамфетамин через энантиоселективная вариация метода P2P, исходя из фенилацетона.
Смотрите также
- MDP2P - родственное соединение с метилендиоксигруппой и предшественник МДМА.
- Циклогексилацетон - в циклогексан производное фенилацетона
- Фенилацетон
- Метамфетамин
Примечания
- ^ 4-гидроксиамфетамин было показано, что метаболизируется в 4-гидроксиноэфедрин дофамин бета-гидроксилазой (DBH) in vitro и предполагается, что он метаболизируется аналогичным образом in vivo.[8][11] Данные исследований, в которых измерялось влияние сывороточных концентраций ДБГ на 4-гидроксиамфетамин метаболизм у людей предполагает, что другой фермент может опосредовать превращение 4-гидроксиамфетамин к 4-гидроксиноэфедрин;[11][13] однако другие данные исследований на животных предполагают, что эта реакция катализируется DBH в синаптические везикулы внутри норадренергических нейронов головного мозга.[14][15]
Справочные заметки
Рекомендации
- ^ «Списки: Плановые действия, контролируемые вещества, регулируемые химические вещества» (PDF). Министерство юстиции США, отдел по борьбе с наркотиками. Цитировать журнал требует
| журнал =(помощь) - ^ а б Крюгер СК, Уильямс Д.Е. (июнь 2005 г.). «Флавинсодержащие монооксигеназы млекопитающих: структура / функция, генетический полиморфизм и роль в метаболизме лекарств». Фармакология и терапия. 106 (3): 357–387. Дои:10.1016 / j.pharmthera.2005.01.001. ЧВК 1828602. PMID 15922018.
Таблица 5: N-содержащие препараты и ксенобиотики, оксигенированные предприятием - ^ а б Кэшман Дж. Р., Сюн Ю. Н., Сюй Л., Яновский А. (март 1999 г.). «N-оксигенация амфетамина и метамфетамина флавин-содержащей монооксигеназой человека (форма 3): роль в биоактивации и детоксикации». Журнал фармакологии и экспериментальной терапии. 288 (3): 1251–1260. PMID 10027866.
- ^ https://archive.org/details/secrets-of-methamphetamine-manufacture-5th-edition-uncle-fester/page/8/mode/2up
- ^ https://www.designer-drug.com/pte/12.162.180.114/dcd/chemistry/p2p.phenylacetic.html / https://www.astm.org/DIGITAL_LIBRARY/JOURNALS/FORENSIC/PAGES/JFS13235J.htm. Аллен А., Стивенсон М., Накамура С. и Эли Р. (1992). «Дифференциация незаконного фенил-2-пропанона, синтезированного из фенилуксусной кислоты с уксусным ангидридом по сравнению с ацетатом свинца (II)». Журнал судебной медицины. 37 (1): 301–322. Дои:10.1520 / JFS13235J. ISSN 0022-1198.
Изучен незаконный синтез фенил-2-пропанона (P2P) в подпольных лабораториях по производству наркотиков из фенилуксусной кислоты и уксусного ангидрида в присутствии ацетата натрия или пиридина или путем сухой перегонки фенилуксусной кислоты и ацетата свинца (II).
CS1 maint: несколько имен: список авторов (связь) - ^ https://pubs.acs.org/doi/10.1021/ja01863a506 Дж. Филип Мейсон; Льюис И. Терри (1 июня 1940 г.). «Приготовление фенилацетона». Варенье. Chem. Soc. 62, 6, 1622. https://doi.org/10.1021/ja01863a506
- ^ «Информация о назначении Adderall XR» (PDF). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Shire US Inc., декабрь 2013 г., стр. 12–13.. Получено 30 декабря 2013.
- ^ а б Гленнон Р.А. (2013). «Стимуляторы фенилизопропиламина: вещества, родственные амфетамину». В Lemke TL, Williams DA, Roche VF, Zito W (ред.). Принципы медицинской химии Фуа (7-е изд.). Филадельфия, США: Wolters Kluwer Health / Lippincott Williams & Wilkins. С. 646–648. ISBN 9781609133450.
Простейший незамещенный фенилизопропиламин, 1-фенил-2-аминопропан или амфетамин, служит общим структурным шаблоном для галлюциногенов и психостимуляторов. Амфетамин оказывает центральное стимулирующее, аноректическое и симпатомиметическое действие, и он является прототипом этого класса (39). ... Фаза 1 метаболизма аналогов амфетамина катализируется двумя системами: цитохромом Р450 и флавинмонооксигеназой. ... Амфетамин также может подвергаться ароматическому гидроксилированию до п-гидроксиамфетамин. ... Последующее окисление в бензильном положении DA-β-гидроксилазой дает п-гидроксиноэфедрин. В качестве альтернативы прямое окисление амфетамина β-гидроксилазой DA может дать норэфедрин.
- ^ Тейлор КБ (январь 1974 г.). «Дофамин-бета-гидроксилаза. Стереохимический ход реакции» (PDF). Журнал биологической химии. 249 (2): 454–458. PMID 4809526. Получено 6 ноября 2014.
Дофамин-β-гидроксилаза катализирует удаление атома водорода pro-R и образование 1-норэфедрина, (2S,1р) -2-амино-1-гидроксил-1-фенилпропан, из d-амфетамина.
- ^ Сантагати Н.А., Феррара Дж., Марраццо А, Ронсисвалле Дж. (Сентябрь 2002 г.). «Одновременное определение амфетамина и одного из его метаболитов методом ВЭЖХ с электрохимическим детектированием». Журнал фармацевтического и биомедицинского анализа. 30 (2): 247–255. Дои:10.1016 / S0731-7085 (02) 00330-8. PMID 12191709.
- ^ а б c Sjoerdsma A, von Studnitz W (апрель 1963 г.). «Активность дофамин-бета-оксидазы у человека с использованием гидроксиамфетамина в качестве субстрата». Британский журнал фармакологии и химиотерапии. 20: 278–284. Дои:10.1111 / j.1476-5381.1963.tb01467.x. ЧВК 1703637. PMID 13977820.
Гидроксиамфетамин вводили перорально пяти людям ... Поскольку превращение гидроксиамфетамина в гидроксинорефедрин происходит in vitro под действием дофамин-β-оксидазы, предлагается простой метод измерения активности этого фермента и действия его ингибиторов у человека. . ... Отсутствие эффекта от введения неомицина одному пациенту свидетельствует о том, что в тканях организма происходит гидроксилирование. ... большая часть β-гидроксилирования гидроксиамфетамина происходит в непочечниковой ткани. К сожалению, в настоящее время нельзя быть полностью уверенным в том, что гидроксилирование гидроксиамфетамина in vivo осуществляется тем же ферментом, который превращает дофамин в норадреналин.
- ^ Badenhorst CP, van der Sluis R, Erasmus E, van Dijk AA (сентябрь 2013 г.). «Конъюгация глицина: важность в метаболизме, роль глицин N-ацилтрансферазы и факторы, влияющие на индивидуальные различия». Мнение эксперта по метаболизму лекарств и токсикологии. 9 (9): 1139–1153. Дои:10.1517/17425255.2013.796929. PMID 23650932.
Рисунок 1. Конъюгация бензойной кислоты глицином. Путь конъюгации глицина состоит из двух этапов. Сначала бензоат лигируется с CoASH с образованием высокоэнергетического тиоэфира бензоил-CoA. Эта реакция катализируется кислотами HXM-A и HXM-B со средней длиной цепи: лигазами CoA и требует энергии в форме АТФ. ... Бензоил-КоА затем конъюгируется с глицином с помощью ГЛИАТ с образованием гиппуровой кислоты, высвобождая CoASH. В дополнение к факторам, перечисленным в рамках, уровни АТФ, CoASH и глицина могут влиять на общую скорость пути конъюгации глицина.
- ^ Хорвиц Д., Александр Р. В., Ловенберг В., Кейзер HR (май 1973 г.). «Человеческая сыворотка дофамин-β-гидроксилазы. Связь с гипертонией и симпатической активностью». Циркуляционные исследования. 32 (5): 594–599. Дои:10.1161 / 01.RES.32.5.594. PMID 4713201.
Биологическое значение различных уровней сывороточной активности DβH изучали двумя способами. Во-первых, способность in vivo к β-гидроксилированию синтетического субстрата гидроксиамфетамина сравнивалась у двух субъектов с низкой активностью DβH в сыворотке и у двух субъектов со средней активностью. ... В одном исследовании гидроксиамфетамин (паредрин), синтетический субстрат для DβH, вводили субъектам с низким или средним уровнем активности DβH в сыворотке. Процент препарата, гидроксилированного до гидроксиноэфедрина, был сопоставим у всех субъектов (6,5–9,62) (таблица 3).
- ^ Фримен Дж. Дж., Салсер Ф (декабрь 1974 г.). «Образование п-гидроксиноэфедрина в головном мозге после внутрижелудочкового введения п-гидроксиамфетамина». Нейрофармакология. 13 (12): 1187–1190. Дои:10.1016/0028-3908(74)90069-0. PMID 4457764.
У видов, где ароматическое гидроксилирование амфетамина является основным путем метаболизма, п-гидроксиамфетамин (POH) и п-гидроксиноэфедрин (PHN) может влиять на фармакологический профиль исходного препарата. ... Расположение пРеакции -гидроксилирования и β-гидроксилирования важны для видов, у которых ароматическое гидроксилирование амфетамина является преобладающим путем метаболизма. После системного введения крысам амфетамина ПОГ было обнаружено в моче и плазме.
Наблюдаемое отсутствие значительного накопления PHN в головном мозге после внутрижелудочкового введения (+) - амфетамина и образования значительных количеств PHN из (+) - POH в ткани мозга in vivo подтверждает мнение о том, что ароматическое гидроксилирование амфетамина происходит после его системное введение происходит преимущественно на периферии, и этот POH затем транспортируется через гематоэнцефалический барьер, поглощается норадренергическими нейронами в головном мозге, где (+) - POH превращается в везикулах хранения с помощью дофамин-β-гидроксилазы в PHN. - ^ Мацуда Л.А., Хэнсон Г.Р., Гибб Дж.В. (декабрь 1989 г.). «Нейрохимические эффекты метаболитов амфетамина на центральную дофаминергическую и серотонинергическую системы». Журнал фармакологии и экспериментальной терапии. 251 (3): 901–908. PMID 2600821.
Метаболизм п-OHA к п-HHor хорошо задокументирован, и допамин-β-гидроксилаза, присутствующая в норадренергических нейронах, может легко преобразовывать п-OHA к п-HHor после внутрижелудочкового введения.