Глютеновая болезнь - Coeliac disease
Глютеновая болезнь или глютеновая болезнь это долгосрочный иммунное расстройство это в первую очередь влияет на тонкий кишечник.[10] Классические симптомы включают желудочно-кишечные проблемы, такие как хронические понос, вздутие живота, нарушение всасывания, потеря аппетита, и среди детей неспособность нормально расти.[1] Это часто начинается в возрасте от шести месяцев до двух лет.[1] Неклассические симптомы встречаются чаще, особенно у людей старше двух лет.[8][15][16] Могут быть легкие или отсутствующие желудочно-кишечные симптомы, большое количество симптомы, затрагивающие любую часть тела или нет явных симптомов.[1] Глютеновая болезнь впервые была описана в детстве;[6][8] однако он может развиться в любом возрасте.[1][8] Это связано с другими аутоиммунные заболевания, такие как Сахарный диабет 1 типа и Тиреоидит Хашимото, среди прочего.[6]
Глютеновая болезнь вызвана реакцией на глютен, группа различных белков, содержащихся в пшеница и в других зерновых, таких как ячмень и рожь.[9][17][18] Умеренное количество овес, без примеси других злаков, содержащих глютен, обычно допускаются.[17][19] Возникновение проблем может зависеть от разнообразие овса.[17][20] Это происходит у людей, которые генетически предрасположен.[10] При воздействии глютена ненормальный невосприимчивый ответ может привести к появлению нескольких различных аутоантитела которые могут повлиять на ряд различных органы.[4][21] В тонкой кишке это вызывает воспалительная реакция и может привести к сокращению ворсинки выстилает тонкий кишечник (атрофия ворсинок ).[10][11] Это влияет на усвоение питательных веществ, что часто приводит к анемия.[10][18]
Диагноз обычно ставится на основе комбинации тестов на антитела крови и кишечного биопсия, чему способствовали конкретные генетическое тестирование.[10] Поставить диагноз не всегда просто.[22] Часто аутоантитела в крови отрицательны,[23][24] и у многих людей есть только незначительные кишечные изменения с нормальными ворсинками.[25] У людей могут быть тяжелые симптомы, и их можно обследовать годами, прежде чем будет установлен диагноз.[26][27] Все чаще диагноз ставится в люди без симптомов, в результате скрининг.[28] Однако данных о влиянии скрининга недостаточно для определения его полезности.[29] Пока болезнь вызвана стойкой непереносимостью белков глютена,[10] это отличается от аллергия на пшеницу, что гораздо реже.[30]
Единственное известное эффективное лечение - это строгое пожизненное безглютеновая диета, что приводит к восстановлению слизистой оболочки кишечника, улучшает симптомы и снижает риск развития осложнений у большинства людей.[13] Если не лечить, это может привести к раки такие как кишечные лимфома и немного повышенный риск ранней смерти.[3] Показатели варьируются в зависимости от региона мира: от 1 из 300 до 1 из 40, в среднем от 1 из 100 до 1 из 170 человек.[14] По оценкам, 80% случаев остаются недиагностированными, обычно из-за минимальных или отсутствующих желудочно-кишечных жалоб и незнания симптомов и диагностических критериев.[5][26][31] Глютеновая болезнь несколько чаще встречается у женщин, чем у мужчин.[32]
Признаки и симптомы
Классические симптомы нелеченой целиакии включают бледный, жидкий или жирный стул (стеаторея ), а также потеря веса или неспособность набрать вес. Другие общие симптомы могут быть незаметными или в основном проявляться не в кишечнике, а в других органах.[33] Также возможно наличие целиакии без каких-либо классических симптомов.[18] Было показано, что это составляет не менее 43% представлений у детей.[34] Кроме того, многие взрослые с легким заболеванием могут проявлять только усталость или анемия.[28] Многие недиагностированные люди, считающие себя бессимптомными, на самом деле таковыми не являются, а скорее привыкли жить в состоянии хронического нарушения здоровья. Действительно, после начала безглютеновой диеты и последующего улучшения становится очевидным, такие люди часто могут ретроспективно вспомнить и распознать предыдущие симптомы своего нелеченого заболевания, которые они по ошибке проигнорировали.[5][27][31]
Желудочно-кишечный тракт
Диарея Характерная для целиакии хроническая болезнь, иногда бледная, большого объема и с аномально неприятным запахом. Боль в животе, спазмы, вздутие живота с вздутие живота (предполагается, что это связано с ферментативным производством кишечного газа), и язвы во рту[35] может присутствовать. По мере того как кишечник становится более поврежденным, степень непереносимость лактозы может развиться.[18] Часто симптомы приписывают синдром раздраженного кишечника (СРК), только позже было признано целиакией. В группах людей с симптомами СРК диагноз целиакии может быть поставлен примерно в 3,3% случаев, что в 4 раза чаще, чем в целом.[36] Скрининг их на целиакию рекомендуется Национальный институт здравоохранения и клинического совершенства (ПРИЯТНО), Британское общество гастроэнтерологов и Американский колледж гастроэнтерологии, но имеет неясные преимущества в Северной Америке.[36][37]
Целиакия ведет к повышенному риску обоих аденокарцинома и лимфома тонкой кишки (энтеропатия-ассоциированная Т-клеточная лимфома (EATL) или другой неходжкинские лимфомы ).[38] Этот риск также выше у родственников первой степени родства, таких как братья и сестры, родители и дети. Неясно, вернет ли безглютеновая диета этот риск к исходному уровню.[39] Длительное и нелеченное заболевание может привести к другим осложнениям, таким как: язвенный еюнит (образование язв в тонкой кишке) и стягивание (сужение в результате рубцевания с непроходимостью кишечника).[40]
Изменения в кишечнике делают его менее способным впитывать питательные вещества, минералы и жирорастворимые витамины A, D, E и K.[18][41]
- Мальабсорбция углеводов и жиров может вызвать потеря веса (или неспособность процветать или Задержка роста у детей) и усталость или недостаток энергии.
- Анемия может развиваться несколькими путями: нарушение всасывания железа может вызвать железодефицитная анемия, и фолиевая кислота и витамин B12 мальабсорбция может вызвать мегалобластная анемия.
- Кальций и Витамин Д мальабсорбция (и компенсаторная вторичная гиперпаратиреоз ) может вызвать остеопения (пониженное содержание минералов в кости) или остеопороз (ослабление костей и риск хрупких переломов).
- Селен мальабсорбция при глютеновой болезни в сочетании с низким содержанием селена во многих безглютеновых продуктах создает риск дефицит селена,[42]
- Медь и недостаток цинка также были связаны с глютеновой болезнью.[42]
- У небольшого количества аномальных коагуляция из-за дефицит витамина К и имеют небольшой риск аномального кровотечения.
Разное
Целиакия связана с рядом заболеваний. Во многих случаях неясно, является ли вызванное глютеном заболевание кишечника причинным фактором или эти состояния имеют общую предрасположенность.
- Дефицит IgA присутствует у 2,3% людей с глютеновой болезнью, и сам по себе связан с десятикратным увеличением риска развития глютеновой болезни. Другими особенностями этого состояния являются повышенный риск инфекций и аутоиммунное заболевание.[43]
- Герпетиформный дерматит, кожное зудящее состояние, связано с ферментом трансглутаминазы в коже, имеет изменения тонкой кишки, идентичные таковым при глютеновой болезни, и может реагировать на отмену глютена даже при отсутствии желудочно-кишечных симптомов.[44][45]
- Нарушение роста и / или задержка пубертата в более позднем детстве может произойти даже без явных кишечных симптомов или тяжелых недоедание. Оценка задержки роста часто включает обследование на целиакию.[18]
- Осложнения беременности может возникнуть, если глютеновая болезнь ранее существовавший или приобретенные позже, со значительными результатами, включая выкидыш, ограничение внутриутробного развития, низкий вес при рождении и преждевременные роды.[46]
- Гипоспленизм (небольшой и малоактивный селезенка )[47] встречается примерно в трети случаев и может предрасполагать к инфекции, учитывая роль селезенки в защите от бактерий.[18]
- Аномальный функциональные пробы печени (случайным образом обнаруживается в анализах крови).[18]
Целиакия связана с несколькими другими заболеваниями, многие из которых являются аутоиммунными: сахарный диабет 1 типа, гипотиреоз, первичный билиарный холангит, микроскопический колит, глютеновая атаксия, псориаз, витилиго, аутоиммунный гепатит, герпетиформный дерматит, первичный склерозирующий холангит, и больше.[4]
Причина
Глютеновая болезнь вызвана реакцией на глиадины и глютенины (глютен белки)[48] содержится в пшенице, и аналогичные белки, обнаруженные в зерновых культурах племя Triticeae (который включает другие распространенные зерна, такие как ячмень и рожь )[18] и племя Aveneae (овес ).[49] Подвиды пшеницы (например, пишется, твердый и Камут ) и гибриды пшеницы (такие как тритикале ) также вызывают симптомы целиакии.[49][50]
Небольшое количество людей с целиакией реагируют на овес.[18] Токсичность овса у людей с глютеновой болезнью зависит от овса сорт потребляется из-за генов проламина, аминокислотных последовательностей белков и иммунореактивность токсичных проламинов, которые различаются между сортами овса.[20][51] Кроме того, овес часто заражается другими злаками, содержащими глютен.[20][51][52] «Чистый овес» относится к овсу, не загрязненному другими злаками, содержащими глютен.[20] Долгосрочные эффекты потребления чистого овса до сих пор неясны.[53] и необходимы дальнейшие исследования для определения используемых сортов, прежде чем давать окончательные рекомендации по их включению в безглютеновая диета.[52] Людям с глютеновой болезнью, которые решают употреблять овес, необходимо более тщательное наблюдение в течение всей жизни, возможно, включая периодическое выполнение кишечная биопсия.[53]
Прочие зерна
Другие злаки, такие как кукуруза, просо, сорго, тефф, рис, и дикий рис безопасны для людей с глютеновой болезнью, а также не зерновые, такие как амарант, Лебеда, и гречиха.[50][54] Незерновые продукты, богатые углеводами, такие как картофель и бананы, не содержат глютен и не вызывают симптомов.[50]
Модификаторы риска
Существуют различные теории относительно того, что определяет, разовьется ли глютеновая болезнь у генетически предрасположенного человека. Основные теории включают хирургическое вмешательство, беременность, инфекцию и эмоциональный стресс.[55]
Употребление в пищу глютена в начале жизни ребенка не увеличивает риск глютеновой болезни, но более позднее введение через 6 месяцев может увеличить его.[56][57] Существует неуверенность в том, что грудное вскармливание снижает риск. Продление кормление грудью до тех пор, пока введение в рацион злаков, содержащих глютен, не приведет к снижению риска развития целиакии в младенчестве на 50%; сохраняется ли это во взрослой жизни, не ясно.[58] Эти факторы могут просто повлиять на время начала.[59]
Патофизиология
Глютеновая болезнь, по-видимому, является многофакторной: заболевание может быть вызвано более чем одним генетическим фактором, а для проявления болезни у человека необходимо более одного фактора.
Почти все люди (95%) с глютеновой болезнью имеют один из вариантов HLA-DQ2 аллель или (реже) HLA-DQ8 аллель.[28][60] Однако около 20–30% людей без целиакии также унаследовали любой из этих аллелей.[61] Это предполагает, что для развития целиакии необходимы дополнительные факторы; то есть предрасполагающий аллель риска HLA необходим, но недостаточен для развития целиакии. Более того, около 5% людей, у которых действительно развивается глютеновая болезнь, не имеют типичных аллелей HLA-DQ2 или HLA-DQ8 (см. Ниже).[28]
Генетика
Подавляющее большинство людей с целиакией имеют один из двух типов HLA-DQ белок.[61] HLA-DQ является частью Антигенпрезентирующий рецептор MHC класса II (также называемый человеческий лейкоцитарный антиген ) системы и различает клетки между собой и не-я для целей иммунная система. Две субъединицы белка HLA-DQ кодируются генами HLA-DQA1 и HLA-DQB1, расположенными на коротком плече хромосома 6.
Там семь HLA-DQ варианты (DQ2 и DQ4 – DQ9). Более 95% людей с целиакией имеют изоформу DQ2 или DQ8, которая передается по наследству в семье. Причина, по которой эти гены увеличивают риск развития целиакии, заключается в том, что рецепторы, образованные этими генами, более тесно связываются с пептидами глиадина, чем другие формы антигенпрезентирующего рецептора. Следовательно, эти формы рецептора с большей вероятностью активируют Т-лимфоциты и инициировать аутоиммунный процесс.[28]

Большинство людей с целиакией несут двухгенный HLA-DQ2. гаплотип упоминается как DQ2.5 гаплотип. Этот гаплотип состоит из двух соседних генов. аллели, DQA1 * 0501 и DQB1 * 0201, которые кодируют две субъединицы, DQ α5 и DQ β2. У большинства людей эта изоформа DQ2.5 кодируется одной из двух хромосом 6, унаследованных от родителей (DQ2.5cis). Большинство больных целиакией наследуют только одну копию этого гаплотипа DQ2.5, в то время как некоторые наследуют его от и то и другое родители; Последние особенно подвержены риску глютеновой болезни, а также более подвержены серьезным осложнениям.[63]
Некоторые люди наследуют DQ2.5 от одного родителя и дополнительную часть гаплотипа (DQB1 * 02 или DQA1 * 05) от другого родителя, что увеличивает риск. Реже некоторые люди наследуют аллель DQA1 * 05 от одного родителя и DQB1 * 02 от другого родителя (DQ2.5trans) (так называемая трансгаплотипическая ассоциация), и эти люди имеют такой же риск развития целиакии, как и люди с одна хромосома 6, несущая DQ2.5, но в этом случае болезнь, как правило, не является наследственной. Среди 6% европейских больных целиакией, у которых нет DQ2.5 (цис или транс) или DQ8 (кодируется гаплотипом DQA1 * 03: DQB1 * 0302), 4% имеют DQ2.2 изоформа, а оставшиеся 2% не содержат DQ2 или DQ8.[64]
Частота этих генов варьируется географически. DQ2.5 очень часто встречается у народов Северной и Западной Европы (Страна Басков и Ирландия[65] с самыми высокими частотами) и в некоторых частях Африки и ассоциируется с болезнями в Индии,[66] но он не встречается в некоторых частях западной части Тихого океана. DQ8 имеет более широкое глобальное распространение, чем DQ2.5, и особенно распространен в Южной и Центральной Америке; до 90% людей в определенных популяциях американских индейцев несут DQ8 и, следовательно, могут иметь целиакию. фенотип.[67]
Неоднократно сообщалось о других генетических факторах при целиакии; однако участие в заболевании имеет разное географическое признание. Только локусы HLA-DQ демонстрируют постоянное участие во всем населении мира.[68] Многие из обнаруженных локусов были обнаружены в связи с другими аутоиммунными заболеваниями. Один локус, LPP или ген-партнер, предпочтительный для липомы, участвует в адгезии внеклеточного матрикса к поверхности клетки, и минорный вариант (SNP = rs1464510) увеличивает риск заболевания примерно на 30%. Этот ген тесно связан с глютеновой болезнью (п < 10−39) в образцах, взятых из обширной территории Европы и США.[68]
Распространенность генотипов целиакии в современной популяции до конца не изучена. Учитывая характеристики болезни и ее очевидную сильную наследственность, обычно можно ожидать, что генотипы будут подвергаться отрицательному отбору и отсутствовать в обществах, где сельское хозяйство практикуется дольше всех (сравните с аналогичным заболеванием, Непереносимость лактозы, который был настолько сильно отобран негативно, что его распространенность снизилась с ~ 100% в наследственных популяциях до менее 5% в некоторых европейских странах). Это ожидание было впервые предложено Simoons (1981).[69] К настоящему времени, однако, очевидно, что это не так; напротив, есть свидетельства положительный селекция генотипов целиакии. Предполагается, что некоторые из них могли быть полезны, обеспечивая защиту от бактериальных инфекций.[70][71]
Проламины
Большинство белков в пище, ответственных за иммунную реакцию при глютеновой болезни, представляют собой проламины. Это запасные белки, богатые пролин (прол-) и глутамин (-амин), которые растворяются в спиртах и устойчивы к протеазы и пептидазы кишечника.[28][72] Проламины содержатся в зернах злаков, причем разные зерна содержат разные, но связанные проламины: пшеница (глиадин), ячмень (Hordein ), рожь (секалин ) и овес (Авенин ).[49] Один регион α-глиадин стимулирует мембранные клетки, энтероциты кишечника, чтобы позволить более крупным молекулам вокруг герметика между клетками. Нарушение узкие стыки разрешить пептиды больше трех аминокислоты проникнуть в слизистую оболочку кишечника.[73]

Утечка через мембрану позволяет пептидам глиадина, которые стимулируют два уровня иммунного ответа, врожденный ответ и адаптивный (опосредованный Т-хелперами) ответ. Один устойчивый к протеазе пептид из α-глиадина содержит область, которая стимулирует лимфоциты и приводит к высвобождению интерлейкин-15. Эта врожденная реакция на глиадин приводит к передаче сигналов иммунной системы, которая привлекает воспалительные клетки и увеличивает высвобождение воспалительных химических веществ.[28] Самый сильный и распространенный адаптивный ответ на глиадин направлен на фрагмент α2-глиадина длиной 33 аминокислоты.[28]
Ответ на 33mer встречается у большинства больных целиакией. а DQ2 изоформа. Этот пептид, измененный кишечной трансглутаминазой, имеет высокую плотность перекрывающихся эпитопов Т-клеток. Это увеличивает вероятность того, что изоформа DQ2 будет связываться и оставаться связанной с пептидом при распознавании Т-клетками.[74] Глиадин, содержащийся в пшенице, является наиболее изученным членом этого семейства, но существуют и другие проламины, а гордеин (из ячменя), секалин (из ржи) и авенин (из овса) могут способствовать глютеновой болезни.[28][49][75] Токсичность авенина у людей с глютеновой болезнью зависит от овса. сорт потребляется из-за генов проламина, аминокислотных последовательностей белков и иммунореактивности токсичных проламинов, которые различаются в зависимости от сорта овса.[20]
Тканевая трансглутаминаза
Антитела против трансглутаминазы к ферменту тканевая трансглутаминаза (tTG) обнаруживаются в крови большинства людей с классическими симптомами и полной атрофией ворсинок, но только в 70% случаев с частичной атрофией ворсинок и в 30% случаев с незначительными поражениями слизистой оболочки.[23] Тканевая трансглутаминаза изменяет глютен пептиды в форму, которая может более эффективно стимулировать иммунную систему.[28] Эти пептиды модифицируются tTG двумя способами: дезамидирование или переамидирование.[76]
Деамидирование - это реакция, при которой остаток глутамата образуется в результате отщепления эпсилон-аминогруппы боковой цепи глутамина. Трансамидирование, которое происходит в три раза чаще, чем дезамидирование, представляет собой перекрестное связывание остатка глутамина из пептида глиадина с остатком лизина tTg в реакции, катализируемой трансглутаминазой. Сшивание может происходить как внутри, так и за пределами активного сайта фермента. В последнем случае образуется постоянно ковалентно связанный комплекс между глиадином и tTg.[77] Это приводит к образованию новых эпитопов, которые, как считается, запускают первичный иммунный ответ, посредством которого развиваются аутоантитела против tTg.[78][79][80]
Сохраненные биопсии людей с подозрением на целиакию показали, что аутоантитело депозиты в субклинический целиакии выявляются до клинического заболевания. Эти отложения также обнаруживаются у людей, страдающих другими аутоиммунными заболеваниями, анемией или явлениями мальабсорбции, гораздо чаще, чем у обычного населения.[81] Считается, что эндомизиальные компоненты антител (EMA) к tTG направлены на трансглутаминазу клеточной поверхности, и эти антитела до сих пор используются для подтверждения диагноза целиакии. Однако исследование 2006 года показало, что EMA-отрицательные люди с целиакией - это, как правило, пожилые мужчины с более серьезными абдоминальными симптомами и меньшей частотой «атипичных» симптомов, включая аутоиммунные заболевания.[82] В этом исследовании отложения антител против tTG не коррелировали с тяжестью разрушения ворсинок. Эти данные в сочетании с недавней работой, показывающей, что глиадин имеет врожденный компонент ответа,[83] предполагают, что глиадин может быть более ответственным за первичные проявления целиакии, тогда как tTG является более важным фактором вторичных эффектов, таких как аллергические реакции и вторичные аутоиммунные заболевания. У большого процента людей с целиакией антитела против tTG также распознают ротавирус белок, названный VP7. Эти антитела стимулируют моноцит распространение и ротавирусная инфекция могут объяснить некоторые ранние шаги в каскаде иммунная клетка распространение.[84]
Действительно, более ранние исследования повреждения кишечника ротавирусом показали, что это вызывает атрофию ворсинок.[85] Это предполагает, что вирусные белки могут принимать участие в начальном выравнивании и стимулировать самореактивную продукцию анти-VP7. Антитела к VP7 также могут замедлять заживление до тех пор, пока опосредованная глиадином презентация tTG не станет вторым источником перекрестно-реактивных антител.
Другие кишечные расстройства могут иметь биопсия которые выглядят как глютеновая болезнь, включая поражения, вызванные Candida.[86]
Атрофия ворсинок и мальабсорбция
Воспалительный процесс, опосредованный Т-клетки, приводит к нарушению структуры и функции слизистой оболочки тонкой кишки и вызывает мальабсорбцию, поскольку это ухудшает способность организма усваивать питательные вещества, минералы и жирорастворимые витамины A, D, E и K от еды. Непереносимость лактозы может быть связана с уменьшением поверхности кишечника и снижением выработки лактаза но обычно проходит после лечения.
Были предложены альтернативные причины этого повреждения тканей, которые включают высвобождение интерлейкин 15 и активация врожденной иммунной системы более коротким пептидом глютена (p31–43 / 49). Это вызовет убийство энтероциты лимфоцитами в эпителий.[28] Атрофия ворсинок, наблюдаемая при биопсии, также может быть вызвана несвязанными причинами, такими как: тропический литник, лямблиоз и лучевой энтерит. В то время как положительный результат серологии и типичная биопсия сильно указывают на глютеновую болезнь, отсутствие реакции на диету может потребовать рассмотрения этих альтернативных диагнозов.[40]
Диагностика
Диагностика часто бывает сложно, и по состоянию на 2019 год среди врачей по-прежнему отсутствует осведомленность о вариабельности форм глютеновой болезни и диагностических критериях, так что большинство случаев диагностируются с большой задержкой.[26][22] На постановку диагноза с момента появления симптомов может уйти до 12 лет, и большинство заболевших в большинстве стран никогда не получают его.[26]
Есть несколько тестов, которые можно использовать. Уровень симптомы может определять порядок тестов, но все тесты теряют свою полезность, если человек уже ест безглютеновая диета. Кишечник повреждение начинает заживать в течение нескольких недель после того, как глютен удаляется из рациона, и антитело уровни снижаются в течение нескольких месяцев. Тем, кто уже перешел на безглютеновую диету, может потребоваться повторный вызов с пищей, содержащей глютен, за один прием пищи в течение 6 недель перед повторным исследованием.[21]
Анализы крови
Серологический Анализы крови - это исследование первой линии, необходимое для постановки диагноза целиакии. Его чувствительность коррелирует со степенью гистологического поражения. Люди с незначительным повреждением тонкой кишки могут иметь серонегативные результаты, поэтому многие пациенты с глютеновой болезнью часто упускаются из виду. У пациентов с атрофией ворсинок анти-эндомизиальный (EMA) антитела иммуноглобулин А (IgA) тип может выявить целиакию с помощью чувствительность и специфичность 90% и 99% соответственно.[87] Серология для антитела к трансглутаминазе (анти-tTG) первоначально сообщалось, что имеет более высокий чувствительность (99%) и специфичность (> 90%). Однако теперь считается, что он имеет характеристики, аналогичные характеристикам антиэндомизиального антитела.[87] И анти-трансглутаминаза, и антиэндомизиальные антитела обладают высокой чувствительностью для диагностики людей с классическими симптомами и полной атрофией ворсинок, но они обнаруживаются только в 30–89% случаев с частичной атрофией ворсинок и менее чем у 50% людей, которые есть незначительные поражения слизистой оболочки (лимфоцитоз двенадцатиперстной кишки ) с нормальными ворсинками.[23][24]
Тканевая трансглутаминаза изменяет глютен пептиды в форму, которая может более эффективно стимулировать иммунную систему.[28] Эти пептиды модифицируются tTG двумя способами: дезамидированием или трансамидированием.[76] Современные тесты на анти-tTG полагаются на человека рекомбинантный белок как антиген.[88] Сначала следует провести тестирование tTG, так как это более простой тест. За неоднозначным результатом теста на tTG должны следовать антиэндомизиальные антитела.[21]
В руководствах рекомендуется параллельно проверять общий уровень IgA в сыворотке, поскольку люди с глютеновой болезнью и дефицитом IgA могут быть неспособны вырабатывать антитела, от которых зависят эти тесты («ложноотрицательный»). У этих людей антитела IgG к трансглутаминазе (IgG-tTG) могут быть диагностическими.[21][89]
Если все эти антитела отрицательны, следует определить антитела против DGP (антитела против дезамидированных пептидов глиадина). Антитела против DGP класса IgG могут быть полезны людям с дефицитом IgA.У детей младше двух лет анти-DGP-антитела работают лучше, чем тесты на антиэндомизиальные и анти-трансглутаминазные антитела.[8]
Поскольку диагноз целиакии имеет большое значение, профессиональные рекомендации рекомендуют анализ крови по-прежнему следует эндоскопия /гастроскопия и биопсия. Отрицательный серологический тест может сопровождаться рекомендацией к эндоскопии и дуоденальный биопсия, если клинические подозрения остаются высокими.[21][40][90]
Исторически измерялись еще три антитела: анти-ретикулин (ARA), анти-глиадин (AGA ) и антиэндомизиальные (EMA) антитела.[91] Однако тестирование ARA недостаточно точно для рутинной диагностики.[92] Серологический анализ у маленьких детей может быть ненадежным.глиадин несколько лучше, чем другие тесты у детей до пяти лет.[91] Серологические тесты основаны на непрямая иммунофлуоресценция (ретикулин, глиадин и эндомизий) или ELISA (глиадин или ткань трансглутаминаза, тТГ).[93]
Другие антитела, такие как антитела против Saccharomyces cerevisiae встречаются у некоторых людей с целиакией, но также встречаются при других аутоиммунных заболеваниях и примерно у 5% тех, кто сдает кровь.[94]
Тест на антитела можно сочетать с HLA тестирование, если диагноз неясен. Тесты TGA и EMA являются наиболее чувствительными тестами на антитела в сыворотке, но, поскольку отрицательный тип HLA-DQ исключает диагноз целиакии, тестирование также на HLA-DQ2 или DQ8 максимизирует чувствительность и отрицательную прогностическую ценность.[61] Однако широкое использование HLA-типирования для исключения целиакии в настоящее время не рекомендуется.[21]
Эндоскопия


An верхняя эндоскопия с участием биопсия из двенадцатиперстная кишка (за пределами луковица двенадцатиперстной кишки ) или тощая кишка выполняется для получения нескольких образцов (от четырех до восьми) из двенадцатиперстной кишки. Не все области могут быть затронуты одинаково; если биопсия берется из здоровой ткани кишечника, результат будет ложноотрицательным.[40] Даже в одном и том же биопсийном фрагменте могут присутствовать разные степени повреждения.[16]
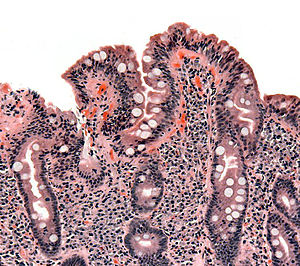
У большинства людей с глютеновой болезнью тонкий кишечник что кажется нормальным при эндоскопии до исследования биопсии. Тем не менее, пять результатов были связаны с высокой специфичностью для целиакии: зубчатость складок тонкой кишки (на фото), малочисленность складок, a мозаика образец для слизистая оболочка (описывается как «потрескавшаяся грязь»), видимость подслизистая основа кровеносный сосуд, и узелковый узор на слизистой оболочке.[95]
Европейские руководящие принципы предполагают, что у детей и подростков с симптомами, совместимыми с глютеновой болезнью, диагноз может быть установлен без биопсии кишечника, если антитела против tTG титры очень высокие (в 10 раз выше верхней границы нормы).[8]
До 1970-х годов биопсии получали с помощью металлических капсул, прикрепленных к отсасывающему устройству. Капсулу проглотили и позволили пройти в тонкий кишечник. После Рентгеновский При проверке ее положения применялось отсасывание для сбора части стенки кишечника внутри капсулы. Часто используемые капсульные системы были Капсула Ватсона и Капсула Кросби – Куглера. Этот метод сейчас в значительной степени заменен на оптоволоконный эндоскопия, которая отличается более высокой чувствительностью и меньшей частотой ошибок.[96]
Капсульная эндоскопия (CE) позволяет идентифицировать типичные изменения слизистой оболочки, наблюдаемые при целиакии, но имеет более низкую чувствительность по сравнению с обычной эндоскопией и гистологией. Следовательно, КЭ не является основным диагностическим средством целиакии. Однако КЭ можно использовать для диагностики Т-клеточной лимфомы, язвенного еюноилеита и аденокарциномы при рефрактерной или осложненной целиакии.[97]
Патология
Классические патологические изменения целиакии в тонкой кишке классифицируются по «классификации Марша»:[98]
- 0 стадия болота: нормальная слизистая
- 1 стадия болота: увеличение количества внутриэпителиальных лимфоциты (IEL), обычно более 20 на 100 энтероциты
- Болотный этап 2: распространение склепы Либеркюн
- Марш 3 этап: частичный или полный ворсистый атрофия и гипертрофия крипт[99]
- 4 этап марша: гипоплазия из тонкий кишечник архитектура
Классификация Марша, введенная в 1992 году, впоследствии была изменена в 1999 году на шесть стадий, где предыдущая стадия 3 была разделена на три подэтапа.[100] Дальнейшие исследования показали, что эта система не всегда была надежной и что изменения, наблюдаемые при целиакии, можно описать на одном из трех этапов:[18][101]
- A представляет собой лимфоцитарную инфильтрацию с нормальным внешним видом ворсинок;
- B1 - частичная атрофия ворсинок; и
- B2, описывающий полную атрофию ворсинок.
Классические изменения улучшаются или отменяются после глютен выводится из рациона. Однако в большинстве руководств не рекомендуется повторная биопсия, если симптомы не улучшаются при соблюдении диеты.[40][90] В некоторых случаях для подтверждения или опровержения диагноза может проводиться преднамеренная провокация глютеном с последующей биопсией. Нормальная биопсия и нормальная серология после заражения указывают на то, что диагноз мог быть неверным.[40]
При нелеченой целиакии атрофия ворсинок чаще встречается у детей младше трех лет, но у детей старшего возраста и взрослых обычно обнаруживаются незначительные поражения кишечника (лимфоцитоз двенадцатиперстной кишки ) с нормальным кишечные ворсинки.[11][25]
Другие диагностические тесты
Во время постановки диагноза могут быть проведены дополнительные исследования для выявления осложнений, таких как: недостаток железа (от полный анализ крови и исследования железа), фолиевая кислота и витамин B12 недостаток и гипокальциемия (низкий уровень кальция, часто из-за снижения Витамин Д уровней). Функциональные тесты щитовидной железы может потребоваться во время анализов крови для выявления гипотиреоз, что чаще встречается у людей с глютеновой болезнью.[41]
Остеопения и остеопороз, умеренно или сильно сниженная минеральная плотность костной ткани, часто присутствует у людей с глютеновой болезнью, и при постановке диагноза могут проводиться исследования для измерения плотности костной ткани, например двухэнергетическая рентгеновская абсорбциометрия (DXA) сканирование для определения риска перелома и потребности в лекарствах для защиты костей.[40][41]
Отказ от глютена
Хотя анализы крови на антитела, биопсия и генетические тесты обычно дают четкий диагноз,[24][87] иногда реакция на отмену глютена на безглютеновая диета необходим для подтверждения диагноза. В настоящее время, вызов глютену больше не требуется для подтверждения диагноза у пациентов с поражениями кишечника, совместимыми с целиакией, и положительным ответом на безглютеновую диету.[24] Тем не менее, в некоторых случаях провокация глютеном с последующей биопсией может быть полезной для подтверждения диагноза, например, у людей с высоким подозрением на целиакию без подтверждения биопсии, у которых есть отрицательные антитела в крови и которые уже принимают глютен. бесплатная диета.[24] Прием глютена не рекомендуется в возрасте до 5 лет и во время пубертатный рост.[102] Альтернативный диагноз не глютеновая чувствительность могут быть сделаны там, где есть только симптоматические доказательства чувствительности к глютену.[103] Желудочно-кишечные и внекишечные симптомы у людей с непереносимостью глютена могут быть аналогичны симптомам глютеновой болезни.[16] и улучшаются, когда глютен удаляется из рациона,[104][105] после глютеновой болезни и аллергия на пшеницу разумно исключены.[106]
До 30% людей часто продолжают иметь или снова проявляют симптомы после перехода на безглютеновую диету.[13] Необходима тщательная интерпретация симптоматической реакции, поскольку отсутствие реакции у человека с глютеновой болезнью может быть связано с продолжающимся приемом небольшого количества глютена, добровольным или непреднамеренным.[11] или быть связано с другими обычно связанными состояниями, такими как избыточный бактериальный рост в тонком кишечнике (СИБО), непереносимость лактозы, фруктоза,[107] сахароза,[108] и сорбитол[109] мальабсорбция, внешнесекреторная недостаточность поджелудочной железы,[110][111] и микроскопический колит,[111] среди прочего. При нелеченой целиакии это часто преходящие состояния, вызванные поражением кишечника.[108][109][112][113][114] Обычно они восстанавливаются или улучшаются через несколько месяцев после начала безглютеновой диеты, но могут потребоваться временные вмешательства, такие как добавление ферменты поджелудочной железы,[113][114] диетические ограничения продуктов, содержащих лактозу, фруктозу, сахарозу или сорбит,[108][112] или лечение пероральными антибиотиками в случае избыточного бактериального роста.[114] В дополнение к отмене глютена некоторым людям необходимо соблюдать низкуюFODMAP диете или избегайте употребления коммерческих продуктов без глютена, которые обычно богаты консерванты и добавки (такие как сульфиты, глутаматы, нитраты и бензоаты ) и может играть роль в запуске функциональных желудочно-кишечных симптомов.[115]
Скрининг
О пользе скрининга ведутся споры. По состоянию на 2017 год Целевая группа профилактических служб США обнаружил недостаточно доказательств, чтобы дать рекомендацию среди лиц без симптомов.[29] В Соединенном Королевстве Национальный институт здравоохранения и клинического совершенства (NICE) рекомендуют пройти тестирование на целиакию у родственников первой степени родства тех, у кого уже подтверждено заболевание, у людей с постоянной усталостью, абдоминальными или желудочно-кишечными симптомами, задержкой роста, необъяснимой потерей веса или дефицитом железа, витамина B12 или фолиевой кислоты, тяжелыми язвами во рту. , а также с диагнозом диабет 1 типа, аутоиммунное заболевание щитовидной железы,[21] и с вновь диагностированным Синдром хронической усталости[116] и синдром раздраженного кишечника.[37] Герпетиформный дерматит входит в другие рекомендации.[117] NICE также рекомендует предлагать серологические тесты на целиакию людям с метаболическая болезнь костей (снижение минеральной плотности костной ткани или остеомаляция ), необъяснимые неврологические расстройства (например, периферическая невропатия и атаксия ), проблемы с фертильностью или повторяющиеся выкидыш, постоянно повышенные ферменты печени по неизвестной причине, дефекты зубной эмали и с диагнозом Синдром Дауна или Синдром Тернера.[21]
Некоторые данные показали, что раннее выявление может снизить риск развития осложнений со здоровьем, таких как остеопороз, анемия и некоторые виды рака, неврологические расстройства, сердечно-сосудистые заболевания, и репродуктивные проблемы.[7][28][46][118][119] Поэтому они рекомендуют обследовать людей с определенными проблемами со здоровьем.[119]
Серология был предложен в качестве скрининг измерения, потому что присутствие антител позволит выявить некоторые ранее не диагностированные случаи целиакии и предотвратить ее осложнения у этих людей. Однако серологические тесты обладают высокой чувствительностью только у людей с полной атрофией ворсинок и имеют очень низкую способность выявлять случаи с частичной атрофией ворсинок или незначительные поражения кишечника.[24] Пациентам с часто ассоциированными заболеваниями может быть предложено обследование на целиакию.[18][21]
лечение
Диета
В настоящее время единственным эффективным методом лечения является пожизненное безглютеновая диета.[50] Не существует лекарств, которые предотвращают повреждение или препятствуют атаке организма на кишечник при наличии глютена. Строгое соблюдение диеты способствует заживлению кишечника, что в большинстве случаев приводит к исчезновению всех симптомов и, в зависимости от того, как скоро начнется диета, также может устранить повышенный риск остеопороза и рака кишечника, а в некоторых случаях - бесплодия.[120] Диета может быть обременительной; несоблюдение диеты может вызвать рецидив.
Диетолог Обычно требуется вводная информация, чтобы убедиться, что человек знает, какие продукты содержат глютен, какие продукты безопасны и как соблюдать сбалансированную диету, несмотря на ограничения. Во многих странах продукты без глютена доступны на рецепт и может быть возмещена медицинская страховка планы. Продукты без глютена обычно дороже и их труднее найти, чем обычные продукты, содержащие глютен.[121] Поскольку готовые продукты часто содержат следы глютена, некоторым больным целиакией может потребоваться приготовление с нуля.[122]
Термин «безглютеновый» обычно используется для обозначения предполагаемого безвредного уровня глютена, а не полного отсутствия.[123] Точный уровень, при котором глютен безвреден, является неопределенным и спорным. Недавний регулярный обзор сделал предварительный вывод, что потребление менее 10 мг глютена в день вряд ли вызовет гистологические отклонения, хотя было отмечено, что было проведено мало надежных исследований.[123] Правила использования этикетки «без глютена» различаются. В Европейском союзе Европейская комиссия в 2009 году издали правила, ограничивающие использование этикеток «без глютена» для пищевых продуктов с содержанием глютена менее 20 мг / кг и этикеток с «очень низким содержанием глютена» для продуктов с содержанием глютена менее 100 мг / кг.[124] В Соединенных Штатах FDA издал правила в 2013 году, ограничивающие использование этикеток "без глютена" для пищевых продуктов теми, у кого менее 20 промилле глютена.[125][126][127] Текущий международный Кодекс Алиментариус Стандарт допускает содержание 20 частей на миллион глютена в так называемых «безглютеновых» продуктах.[128] Некоторые организации, такие как Организация по сертификации безглютеновых продуктов (GFCO), Ассоциация глютеновых спру (CSA) и Национальный фонд осведомленности о целиакии (NFCA), также сертифицируют продукты и компании как продукты, не содержащие глютен.[129]
Улучшается безглютеновая диета качество жизни, связанное со здравоохранением, а строгое соблюдение диеты приносит больше пользы, чем ее неполное. Тем не менее, безглютеновая диета полностью не нормализует качество жизни.[130]
Рефрактерная болезнь
От 0,3% до 10% людей страдают рефрактерным заболеванием, что означает стойкую атрофию ворсинок на безглютеновой диете, несмотря на отсутствие воздействия глютена в течение более 12 месяцев.[111] Тем не менее, непреднамеренное воздействие глютена является основной причиной стойкой атрофии ворсинок и должно быть исключено до постановки диагноза рефрактерной болезни.[111] Люди с низким базовым образованием и пониманием безглютеновой диеты часто считают, что они строго соблюдают диету, но совершают регулярные ошибки.[13][111][131] Кроме того, отсутствие симптомов не является надежным показателем восстановления кишечника.[111]
Если альтернативные причины атрофии ворсинок устранены, стероиды или иммунодепрессанты (такие как азатиоприн ) можно рассмотреть в этом сценарии.[40]
Рефрактерную целиакию не следует путать с сохранением симптомов, несмотря на отмену глютена.[111] вызванные переходными состояниями, вызванными повреждением кишечника,[108][109][112] которые обычно восстанавливаются или улучшаются через несколько месяцев после начала безглютеновой диеты,[113][114] такие как избыточный бактериальный рост в тонком кишечнике, непереносимость лактозы, фруктоза,[107] сахароза,[108] и сорбитол[109] мальабсорбция, внешнесекреторная недостаточность поджелудочной железы,[110][111] и микроскопический колит[111] среди прочего.
Эпидемиология
В глобальном масштабе глютеновой болезнью страдает от 1 из 100 до 1 из 170 человек.[14][132] Тем не менее, в разных регионах мира показатели варьируются от 1 из 300 до 1 из 40.[14] В Соединенных Штатах считается, что он поражает от 1 из 1750 (определяется как клиническое заболевание, включая герпетиформный дерматит с ограниченными симптомами со стороны пищеварительного тракта) до 1 из 105 (определяется по наличию IgA TG у доноров крови).[133] Считается, что из-за различных признаков и симптомов около 85% людей не диагностированы.[134] В различных исследованиях процент людей с клинически диагностированным заболеванием (симптомы, требующие диагностического тестирования) составляет 0,05–0,27%. Однако исследования населения в некоторых частях Европы, Индии, Южной Америки, Австралии и США (с использованием серологии и биопсии) показывают, что процент людей с этим заболеванием может составлять от 0,33 до 1,06% среди детей (но 5,66% в одном исследовании дети предрасположенных Сахарский народ[135]) и 0,18–1,2% у взрослых.[28] Среди лиц, оказывающих первичную медицинскую помощь, которые сообщают о желудочно-кишечных симптомах, уровень глютеновой болезни составляет около 3%.[87] В Австралии этим заболеванием болеет примерно 1 из 70 человек.[136] Показатель среди взрослых доноров крови в Иран, Израиль, Сирия и индюк составляет 0,60%, 0,64%, 1,61% и 1,15% соответственно.[39]
Люди африканского, японского и китайского происхождения редко диагностируются;[137] это отражает гораздо меньшую распространенность генетического факторы риска, такие как HLA-B8.[138] Похоже, что люди индийского происхождения имеют такой же риск, что и люди западного кавказского происхождения.[39] Популяционные исследования также показывают, что большая часть случаев целиакии остается невыявленной; Отчасти это связано с тем, что многие врачи не знакомы с этим заболеванием, а также с тем, что оно может протекать бессимптомно.[139] Глютеновая болезнь несколько чаще встречается у женщин, чем у мужчин.[32] Крупное многоцентровое исследование в США обнаружило распространенность 0,75% в группах, не входящих в группу риска, увеличиваясь до 1,8% у людей с симптомами, 2,6% у родственников второй степени родства (например, бабушек и дедушек, тети или дяди, внуков и т. Д.). человек с глютеновой болезнью и 4,5% среди родственников первой степени родства (братьев и сестер, родителей или детей).[39] Этот профиль аналогичен распространенности в Европе.[39] Другие группы населения с повышенным риском развития целиакии с уровнем распространенности от 5% до 10% включают лиц с вниз и Синдромы Тернера, диабет 1 типа и аутоиммунное заболевание щитовидной железы, включая оба гипертиреоз (сверхактивный щитовидная железа ) и гипотиреоз (пониженная активность щитовидной железы).[140]
Исторически считалось, что целиакия встречается редко, с распространенностью около 0,02%.[140] Причина недавнего увеличения числа зарегистрированных случаев неясна.[132] Частично это может быть связано с изменениями в диагностической практике.[141] Также кажется, что истинное увеличение примерно в 4,5 раза может быть связано с меньшим воздействием бактерий и других патогенов в западной среде.[132] В США средний возраст постановки диагноза составляет 38 лет.[142] Примерно 20 процентов людей с глютеновой болезнью диагностируются после 60 лет.[142]
История
Термин «глютеновая болезнь» происходит от Греческий κοιλιακός (koiliakós, «брюшной») и был введен в 19 веке в переводе того, что обычно считается Древнегреческий описание болезни Аретей Каппадокийский.[143][144]
Люди впервые начали выращивать зерновые в Неолит период (начало около 9500 г. до н.э.) в Плодородный Полумесяц в Западной Азии, и вполне вероятно, что до этого времени глютеновая болезнь не возникала. Аретей Каппадокийский, живущий во втором веке в том же районе, зарегистрировал синдром мальабсорбции с хронической диареей, вызывающей истощение всего тела.[143] Его "Целиакская привязанность" (целиакия с греческого κοιλιακός Koiliakos, «брюшной») привлекли внимание западной медицины, когда Фрэнсис Адамс представил перевод работы Аретея в Обществе Сиденхэма в 1856 году. Пациент, описанный в работе Аретея, страдал от боли в животе, был атрофирован, бледен, слаб и не мог работать. Диарея проявлялась в виде жидкого стула, который был белым, зловонным и метеоризмом, болезнь была трудноизлечимой и периодически возвращалась. Проблема, по мнению Аретея, заключалась в недостатке тепла в желудке, необходимом для переваривания пищи, и в сниженной способности распределять продукты пищеварения по всему телу, это неполное пищеварение приводило к диарее. Он считал это недугом пожилых людей и чаще затрагивал женщин, явно исключая детей. Причина, по словам Аретея, иногда заключалась либо в другом хроническом заболевании, либо даже в «обильном глотке холодной воды».[143][144]
В педиатр Сэмюэл Джи дал первое современное описание состояния у детей на лекции в Больница для больных детей, Грейт-Ормонд-стрит, Лондон, 1887 г. Джи признал более ранние описания и термины для болезни и принял тот же термин, что и Аретей (целиакия). Он проницательно заявил: «Если пациента вообще можно вылечить, это должно быть с помощью диеты». Джи признал, что непереносимость молока является проблемой для детей с глютеновой болезнью и что следует избегать сильно накрахмаленных продуктов. Однако он запретил рис, саго, фрукты и овощи, которые можно было есть, и рекомендовал сырое мясо, а также тонкие ломтики поджаренного хлеба. Джи отметил особый успех у ребенка, «которого накормили квартой лучшего голландского моллюски ежедневно ». Однако ребенок не мог выдерживать эту диету более одного сезона.[144][145]
Кристиан Арчибальд Гертер, американский врач, в 1908 году написал книгу о детях с глютеновой болезнью, которую он назвал "кишечной болезнью". инфантилизм «Он отметил, что их рост замедлен и что жир переносится лучше, чем углеводы. эпоним Болезнь Джи-Хертера иногда использовался для признания обоих вкладов.[146][147] Сидней В. Хаас, американский педиатр, сообщил о положительном эффекте банановая диета в 1924 г.[148] Эта диета оставалась в моде до тех пор, пока не была определена реальная причина целиакии.[144]
Хотя предполагалась роль углеводов, связь с пшеницей не была установлена до 1940-х годов голландским педиатром доктором Виллем Карел Дике.[149] Вполне вероятно, что клиническое улучшение его пациентов во время Голландский голод 1944 года (во время которого муки не хватало), возможно, способствовали его открытию.[150] Дике заметил, что нехватка хлеба привела к значительному снижению смертности среди детей, страдающих целиакией, с более чем 35% до практически нуля. Он также сообщил, что, как только пшеница снова стала доступной после конфликта, уровень смертности вырос до прежнего уровня.[151] Связь с глютеновым компонентом пшеницы была установлена в 1952 году командой из Бирмингем, Англия.[152] Атрофия ворсинок была описана британским врачом Джоном У. Полли в 1954 году на образцах, взятых во время операции.[153] Это открыло путь для образцов биопсии, взятых при эндоскопии.[144]
На протяжении 1960-х годов выяснялись и другие особенности целиакии. Его наследственность была признана в 1965 году.[154] В 1966 году герпетиформный дерматит был связан с чувствительность к глютену.[144][44]
Социум и культура
Май был объявлен «Месяцем осведомленности о целиакии» несколькими организациями, занимающимися глютеновой болезнью.[155][156]
Христианские церкви и Евхаристия
Вообще говоря, различные конфессии христиан празднуют Евхаристия в котором вафля или небольшой кусочек сакраментальный хлеб из пшеничного хлеба освящают, а затем едят. Типичная вафля весит около полграмма.[157] Пшеничная мука содержит от 10 до 13% глютена, поэтому одна вафля для причастия может содержать более 50 мг глютена, количество, которое вредит многим людям с глютеном, особенно при ежедневном употреблении (см. Диета над).
Многие христианские церкви предлагают своим прихожанам альтернативы без глютена, обычно в виде рисовых крекеров или безглютенового хлеба. К ним относятся Объединенный методист, Христианский реформатор, Епископальный, Англиканская церковь (Англиканская церковь, Великобритания) и Лютеранский. Католики может получать только из Чаши или просить хозяев с пониженным содержанием глютена; безглютеновые, однако, не считаются пшеничным хлебом и, следовательно, недействительными.[158]
Римско-католическая позиция
Римский католик доктрина заявляет, что для действительного Евхаристия, хлеб, который будет использоваться в Масса должен быть сделан из пшеницы. С низким содержанием глютена хозяева отвечают всем требованиям католической церкви, но не полностью без глютена. Запросы на использование рисовых вафель были отклонены.[159]
У священников вопрос сложнее. Как совершающий, священник для полноты жертвоприношения Мессы абсолютно необходим для получения под обоими видами. 24 июля 2003 года Конгрегация доктрины веры заявила: «Учитывая центральное место празднования Евхаристии в жизни священника, нужно действовать с большой осторожностью, прежде чем допустить в Священный орден тех кандидатов, которые не могут принимать глютен или алкоголь без серьезного вреда ".[160]
К январю 2004 года одобренные Церковью хосты с очень низким содержанием глютена стали доступны в Соединенных Штатах, Италии и Австралии.[161] По состоянию на июль 2017 года Ватикан по-прежнему запретил использование безглютенового хлеба для причастия.[162]
Пасха
Еврейский фестиваль Песах (Песах) может вызвать проблемы с обязательством есть маца, который представляет собой пресный хлеб, приготовленный строго контролируемым образом из пшеницы, ячменя, пишется, овес или рожь. Это исключает многие другие злаки, которые обычно используются в качестве заменителей для людей с чувствительностью к глютену, особенно Евреи ашкенази, которые также избегают риса. Многие кошерные продукты на Пасху вообще не содержат злаков и, следовательно, не содержат глютен. Картофельный крахмал это первичный крахмал, используемый для замены зерен.
Орфография
Целиакия - предпочтительное написание в Британский английский, в то время как глютеновая болезнь обычно используется при Североамериканский английский.[163][164]
Направления исследований
Поиск факторов окружающей среды, которые могут быть ответственными за то, что генетически предрасположенные люди становятся непереносимыми к глютену, привел к увеличению исследовательской активности, связанной с желудочно-кишечными инфекциями.[165] Исследование, опубликованное в апреле 2017 года, предполагает, что часто протекающая бессимптомная инфекция обычным штаммом реовирус может повысить чувствительность к таким продуктам, как глютен.[166]
Изучаются различные подходы к лечению, в том числе те, которые уменьшили бы потребность в диете. Все они все еще находятся в стадии разработки и пока не будут доступны широкой публике.[28][167][168]
В качестве новых терапевтических средств лечения целиакии были предложены три основных подхода: детоксикация глютена, регулирование кишечная проницаемость и модуляция иммунного ответа.[169]
С помощью генно-инженерный виды пшеницы или виды пшеницы, которые были выборочно выведенный быть минимально иммуногенным, может допускать употребление пшеницы. Однако это может повлиять на влияние глиадина на качество теста. В качестве альтернативы воздействие глютена можно свести к минимуму путем приема комбинации ферменты (пролилэндопептидаза и специфический для глютамина ячменя цистеин эндопептидаза (EP-B2 )), которые разрушают предполагаемый 33-мерный пептид в двенадцатиперстная кишка.[28]
Альтернативные методы лечения, которые исследуются, включают ингибирование зонулин, эндогенный сигнальный белок, связанный с повышенной проницаемостью стенки кишечника и, следовательно, повышенным представлением глиадина иммунной системе. Одним из ингибиторов этого пути является ларазотида ацетат, который в настоящее время запланирован на фазу 3 клинических испытаний.[170] Другие модификаторы других хорошо изученных стадий патогенеза целиакии, такие как действие HLA-DQ2 или тканевой трансглутаминазы и взаимодействие MICA / NKG2D, которые могут участвовать в уничтожении энтероцитов.[28]
Попытки модулировать иммунный ответ в отношении целиакии в основном все еще находятся в фазе I клинических испытаний; один агент (CCX282-B) был оценен в клинических испытаниях фазы II на основе биопсий тонкого кишечника, взятых у людей с глютеновой болезнью до и после воздействия глютена.[169]
Хотя обычно используется как альтернативное лечение для людей с аутизмом нет убедительных доказательств того, что безглютеновая диета приносит пользу.[171][172][173] В подмножестве людей, у которых чувствительность к глютену Имеются ограниченные данные, свидетельствующие о том, что безглютеновая диета может улучшить некоторые виды аутистического поведения.[171][174][175]
использованная литература
- ^ а б c d е ж Фазано А (апрель 2005 г.). «Клинические проявления целиакии в педиатрической популяции». Гастроэнтерология (Обзор). 128 (4 Дополнение 1): S68–73. Дои:10.1053 / j.gastro.2005.02.015. PMID 15825129.
- ^ «Симптомы и причины целиакии | NIDDK». Национальный институт диабета, болезней органов пищеварения и почек. Июнь 2016 г. В архиве из оригинала 24 апреля 2017 г.. Получено 24 апреля 2017.
- ^ а б Лебволь Б., Людвигссон Дж. Ф., Грин PH (октябрь 2015 г.). «Целиакия и непереносимость глютена». BMJ (Обзор). 351: h4347. Дои:10.1136 / bmj.h4347. ЧВК 4596973. PMID 26438584.
Целиакия встречается примерно у 1% населения во всем мире, хотя у большинства людей это заболевание не диагностируется. Это может вызвать широкий спектр симптомов, как кишечных, так и внекишечных, потому что это системное аутоиммунное заболевание, которое вызывается диетическим глютеном. Пациенты с глютеновой болезнью имеют повышенный риск рака, включая двукратный или четырехкратный повышенный риск неходжкинской лимфомы и более чем 30-кратный повышенный риск аденокарциномы тонкого кишечника, а также у них в 1,4 раза повышенный риск смерти.
- ^ а б c Лундин К.Е., Вейменга С. (сентябрь 2015 г.). «Целиакия и аутоиммунные заболевания - генетическое совпадение и скрининг». Обзоры природы. Гастроэнтерология и гепатология (Обзор). 12 (9): 507–15. Дои:10.1038 / nrgastro.2015.136. PMID 26303674. S2CID 24533103.
Аномальный иммунологический ответ, вызываемый белками, производными глютена, может привести к выработке нескольких различных аутоантител, которые влияют на разные системы.
- ^ а б c «Целиакия». Всемирная гастроэнтерологическая организация Глобальные рекомендации. Июль 2016 г. В архиве из оригинала 17 марта 2017 г.. Получено 23 апреля 2017.
- ^ а б c d Ciccocioppo R, Kruzliak P, Cangemi GC, Pohanka M, Betti E, Lauret E, Rodrigo L (22 октября 2015 г.). «Спектр различий между глютеновой болезнью у детей и взрослых». Питательные вещества (Обзор). 7 (10): 8733–51. Дои:10.3390 / nu7105426. ЧВК 4632446. PMID 26506381.
Несколько дополнительных исследований на обширных сериях пациентов с глютеновой болезнью ясно показали, что чувствительность к TG2A варьируется в зависимости от тяжести дуоденального повреждения и достигает почти 100% при полной атрофии ворсинок (чаще встречается у детей до трех лет), 70% для субтотального. атрофия и до 30%, когда присутствует только увеличение IEL. (IELs: интраэпителиальные лимфоциты)
- ^ а б Lionetti E, Francavilla R, Pavone P, Pavone L, Francavilla T, Pulvirenti A, Giugno R, Ruggieri M (август 2010 г.). «Неврология целиакии в детстве: какие доказательства? Систематический обзор и метаанализ». Медицина развития и детская неврология. 52 (8): 700–7. Дои:10.1111 / j.1469-8749.2010.03647.x. PMID 20345955.
- ^ а б c d е ж Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Mäki M, Ribes-Koninckx C, Ventura A, Zimmer KP, ESPGHAN Рабочая группа по диагностике целиакии; Комитет гастроэнтерологии ESPGHAN; Европейское общество детской гастроэнтерологии, гепатологии и питания (январь 2012 г.). «Рекомендации Европейского общества детской гастроэнтерологии, гепатологии и питания по диагностике целиакии» (PDF). J Педиатр Гастроэнтерол Нутр (Практическое руководство). 54 (1): 136–60. Дои:10.1097 / MPG.0b013e31821a23d0. PMID 22197856. S2CID 15029283. Архивировано из оригинал (PDF) 3 апреля 2016 г.. Получено 19 марта 2016.
С 1990 года понимание патологических процессов БК значительно расширилось, что привело к изменению клинической парадигмы БК с хронической глютен-зависимой энтеропатии детского возраста на системное заболевание с хроническими иммунными особенностями, поражающими различные системы органов. (...) атипичные симптомы могут встречаться значительно чаще, чем классические симптомы
- ^ а б Товоли Ф, Маси С., Гвидетти Э, Негрини Дж., Патерини П., Болонди Л. (март 2015 г.). «Клинические и диагностические аспекты нарушений, связанных с глютеном». Всемирный журнал клинических случаев (Обзор). 3 (3): 275–84. Дои:10.12998 / wjcc.v3.i3.275. ЧВК 4360499. PMID 25789300.
- ^ а б c d е ж г «Целиакия». NIDDKD. Июнь 2015 г. В архиве из оригинала 13 марта 2016 г.. Получено 17 марта 2016.
- ^ а б c d Вивас С., Вакеро Л., Родригес-Мартин Л., Каминеро А. (ноябрь 2015 г.). «Возрастные различия при глютеновой болезни: специфические характеристики у взрослых». Всемирный журнал желудочно-кишечной фармакологии и терапии (Обзор). 6 (4): 207–12. Дои:10.4292 / wjgpt.v6.i4.207. ЧВК 4635160. PMID 26558154.
Кроме того, наличие интраэпителиального лимфоцитоза и / или атрофии ворсинок и гиперплазии крипт слизистой оболочки тонкой кишки, а также клиническая ремиссия после отмены глютена из рациона также используются для диагностики титров антитрансглютаминазных антител (tTGA) и степени гистологических поражений. обратно пропорциональны возрасту. Таким образом, с возрастом диагноза титры антител снижаются, а гистологические повреждения менее выражены. Часто в биоптатах слизистой оболочки двенадцатиперстной кишки можно найти взрослых без атрофии ворсинок, показывающих только воспалительный паттерн: лимфоцитарный энтерит (Марш I) или гиперплазию крипт (Марш II)
- ^ Ферри, Фред Ф. (2010). Дифференциальный диагноз Ферри: практическое руководство по дифференциальной диагностике симптомов, признаков и клинических расстройств (2-е изд.). Филадельфия, Пенсильвания: Эльзевьер / Мосби. п. Глава C. ISBN 978-0323076999.
- ^ а б c d См. JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA (октябрь 2015 г.). «Практические советы по безглютеновой диете». Обзоры природы. Гастроэнтерология и гепатология (Обзор). 12 (10): 580–91. Дои:10.1038 / nrgastro.2015.156. PMID 26392070. S2CID 20270743.
Отсутствие симптомов и / или отрицательные серологические маркеры не являются надежными индикаторами реакции слизистой оболочки на диету. Кроме того, до 30% пациентов продолжают иметь желудочно-кишечные симптомы, несмотря на строгий GFD.122,124 Если соблюдение режима лечения ставится под сомнение, структурированное интервью с квалифицированным диетологом может помочь выявить как преднамеренные, так и случайные источники глютена.
- ^ а б c d Фазано А., Катасси С. (декабрь 2012 г.). «Клиническая практика. Целиакия». Медицинский журнал Новой Англии (Обзор). 367 (25): 2419–26. Дои:10.1056 / NEJMcp1113994. PMID 23252527.
- ^ Ньюнхэм, Эван Д. (2017). «Целиакия в 21 веке: сдвиги парадигмы в современную эпоху». Журнал гастроэнтерологии и гепатологии. 32: 82–85. Дои:10.1111 / jgh.13704. PMID 28244672. S2CID 46285202.
Появление БК с симптомами мальабсорбции или недоедания в настоящее время является скорее исключением, чем правилом.
- ^ а б c Тонутти Э, Биццаро Н (2014). «Диагностика и классификация целиакии и чувствительности к глютену». Аутоиммунный Rev. 13 (4–5): 472–6. Дои:10.1016 / j.autrev.2014.01.043. PMID 24440147.
- ^ а б c Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (ноябрь 2013 г.). «Безглютеновая диета у детей: подход к полноценному и сбалансированному питанию». Питательные вещества (Обзор). 5 (11): 4553–65. Дои:10.3390 / nu5114553. ЧВК 3847748. PMID 24253052.
- ^ а б c d е ж г час я j k л Ди Сабатино A, Corazza GR (апрель 2009 г.). "Глютеновая болезнь". Ланцет. 373 (9673): 1480–93. Дои:10.1016 / S0140-6736 (09) 60254-3. PMID 19394538. S2CID 8415780.
- ^ Пинто-Санчес М.И., Каусада-Кало Н., Берчик П., Форд А.С., Мюррей Д.А., Армстронг Д., Семрад С., Купфер С.С., Алаедин А., Моайеди П., Леффлер Д.А., Верду Е.Ф., Грин П. (август 2017 г.). «Безопасность добавления овса к безглютеновой диете для пациентов с целиакией: систематический обзор и метаанализ клинических и наблюдательных исследований» (PDF). Гастроэнтерология. 153 (2): 395–409.e3. Дои:10.1053 / j.gastro.2017.04.009. PMID 28431885.
- ^ а б c d е Комино I, Морено М., Соуза С. (ноябрь 2015 г.). «Роль овса при глютеновой болезни». Всемирный журнал гастроэнтерологии. 21 (41): 11825–31. Дои:10.3748 / wjg.v21.i41.11825. ЧВК 4631980. PMID 26557006.
Необходимо учитывать, что овес включает множество разновидностей, содержащих различные аминокислотные последовательности и проявляющих различную иммунореактивность, связанную с токсичными проламинами. В результате несколько исследований показали, что иммуногенность овса варьируется в зависимости от потребляемого сорта. Таким образом, важно тщательно изучить разновидность овса, используемого в пищевом ингредиенте, прежде чем включать его в безглютеновую диету.
- ^ а б c d е ж г час я Национальный институт здравоохранения и клинического совершенства. Клиническое руководство 86: Распознавание и оценка целиакии. Лондон, 2015 год.
- ^ а б Маттиас Т., Пфайфер С., Селми К., Эрик Гершвин М. (апрель 2010 г.). «Диагностические проблемы при целиакии и роль тканевой трансглутаминазы-неоэпитопа». Clin Rev Allergy Immunol (Обзор). 38 (2–3): 298–301. Дои:10.1007 / s12016-009-8160-z. PMID 19629760. S2CID 33661098.
- ^ а б c Льюис Н.Р., Скотт Б.Б. (июль 2006 г.). «Систематический обзор: использование серологии для исключения или диагностики целиакии (сравнение тестов на антитела к эндомизиальной и тканевой трансглутаминазе)». Пищевая фармакология и терапия. 24 (1): 47–54. Дои:10.1111 / j.1365-2036.2006.02967.x. PMID 16803602. S2CID 16823218.
- ^ а б c d е ж Ростом А., Мюррей Дж. А., Кагнофф М. Ф. (декабрь 2006 г.). «Технический обзор Института Американской Гастроэнтерологической Ассоциации (AGA) по диагностике и лечению целиакии». Гастроэнтерология (Обзор). 131 (6): 1981–2002. Дои:10.1053 / j.gastro.2006.10.004. PMID 17087937.
- ^ а б Молина-Инфанте Дж., Сантолария С., Сандерс Д.С., Фернандес-Баньярес Ф. (май 2015 г.). «Систематический обзор: нецелочная чувствительность к глютену». Пищевая фармакология и терапия (Обзор). 41 (9): 807–20. Дои:10.1111 / apt.13155. PMID 25753138. S2CID 207050854.
Кроме того, серонегативность чаще встречается у пациентов с целиакией без атрофии ворсинок (поражения Марша 1-2), но эти «второстепенные» формы целиакии могут иметь клинические проявления, сходные с таковыми с атрофией ворсинок, и могут демонстрировать аналогичную клинико-гистологическую ремиссию с обратимостью гематологических или биохимических нарушений на безглютеновой диете (GFD).
- ^ а б c d Цичевич А.Б., Мирнс Э.С., Тейлор А., Буланже Т., Гербер М., Леффлер Д.А. и др. (1 марта 2019 г.). "Диагностика и схемы лечения целиакии". Dig Dis Sci (Обзор). 64 (8): 2095–2106. Дои:10.1007 / s10620-019-05528-3. PMID 30820708. S2CID 71143826.
- ^ а б Людвигссон Дж. Ф., Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, Ciacci C (апрель 2015 г.). «Поддержка пациентов с целиакией: обзор литературы». Единый европейский гастроэнтерологический журнал (Обзор). 3 (2): 146–59. Дои:10.1177/2050640614562599. ЧВК 4406900. PMID 25922674.
- ^ а б c d е ж г час я j k л м п о п q ван Хил Д.А., Вест Дж. (июль 2006 г.). «Последние достижения в области глютеновой болезни». Кишечник (Обзор). 55 (7): 1037–46. Дои:10.1136 / gut.2005.075119. ЧВК 1856316. PMID 16766754.
- ^ а б Биббинс-Доминго К., Гроссман Д.К., Карри С.Дж., Барри М.Дж., Дэвидсон К.В., Дубени К.А., Эбелл М., Эплинг Д.В., Герцштейн Дж., Кемпер А.Р., Крист А.Х., Курт А.Е., Ландефельд С.С., Менджоне С.М., Фиппс М.Г., Сильверстайн М. Саймон М.А., Ценг CW (март 2017 г.). «Скрининг на целиакию: Рекомендация рабочей группы США по профилактическим услугам». JAMA. 317 (12): 1252–1257. Дои:10.1001 / jama.2017.1462. PMID 28350936. S2CID 205086614.
- ^ Burkhardt, J. G .; Chapa-Rodriguez, A .; Бахна, С. Л. (июль 2018 г.). «Чувствительность к глютену и аллерголог: обмолота зерна из шелухи». Аллергия. 73 (7): 1359–1368. Дои:10.1111 / все.13354. PMID 29131356.
- ^ а б Лионетти Э, Гатти С., Пульвиренти А., Катасси С. (июнь 2015 г.). «Целиакия с глобальной точки зрения». Лучшие практики и исследования. Клиническая гастроэнтерология (Обзор). 29 (3): 365–79. Дои:10.1016 / j.bpg.2015.05.004. PMID 26060103.
- ^ а б Хишенхубер С., Кревель Р., Джарри Б., Мяки М., Монерет-Вотрен Д.А., Романо А., Тронконе Р., Уорд Р. (март 2006 г.). «Обзорная статья: безопасное количество глютена для пациентов с аллергией на пшеницу или целиакией». Пищевая фармакология и терапия. 23 (5): 559–75. Дои:10.1111 / j.1365-2036.2006.02768.x. PMID 16480395. S2CID 9970042.
- ^ Шуппан Д., Циммер К.П. (декабрь 2013 г.). «Диагностика и лечение целиакии». Deutsches Ärzteblatt International. 110 (49): 835–46. Дои:10.3238 / arztebl.2013.0835. ЧВК 3884535. PMID 24355936.
- ^ Vriezinga SL, Schweizer JJ, Koning F, Mearin ML (сентябрь 2015 г.). «Целиакия и расстройства, связанные с глютеном в детстве». Обзоры природы. Гастроэнтерология и гепатология (Обзор). 12 (9): 527–36. Дои:10.1038 / nrgastro.2015.98. PMID 26100369. S2CID 2023530.
- ^ Фергюсон Р., Басу М.К., Асквит П., Кук В.Т. (1976). «Аномалии слизистой оболочки тощей кишки у пациентов с рецидивирующими афтозными язвами». Br Med J. 1 (6000): 11–13. Дои:10.1136 / bmj.1.6000.11. ЧВК 1638254. PMID 1247715.
- ^ а б Ирвин, AJ; Чей, WD; Ford, AC (январь 2017 г.). «Скрининг целиакии при синдроме раздраженного кишечника: обновленный систематический обзор и метаанализ» (PDF). Американский журнал гастроэнтерологии. 112 (1): 65–76. Дои:10.1038 / ajg.2016.466. PMID 27753436. S2CID 269053.
- ^ а б Национальный институт здравоохранения и клинического совершенства. Клиническое руководство 61: Синдром раздраженного кишечника. Лондон, 2008 год.
- ^ Фазано Алессио, Кайо Джакомо; Катасси Карло, Вольта Умберто (июль 2019 г.). «Целиакия: всеобъемлющий текущий обзор». BMC Медицина. Springer Nature. 17 (1): 142. Дои:10.1186 / s12916-019-1380-z. ЧВК 6647104. PMID 31331324.
- ^ а б c d е Гуджрал Н., Фриман Х. Дж., Томсон А.Б. (ноябрь 2012 г.). «Целиакия: распространенность, диагностика, патогенез и лечение» (PDF). Всемирный журнал гастроэнтерологии. 18 (42): 6036–59. Дои:10.3748 / wjg.v18.i42.6036. ЧВК 3496881. PMID 23155333. Архивировано из оригинал (PDF) 20 марта 2014 г.
- ^ а б c d е ж г час «Заявление о медицинской позиции Американской гастроэнтерологической ассоциации: целиакия». Гастроэнтерология. 120 (6): 1522–5. 2001. Дои:10.1053 / gast.2001.24055. PMID 11313323. S2CID 28235994.
- ^ а б c Presutti RJ, Cangemi JR, Кэссиди HD, Хилл Д.А. (2007). «Целиакия». Am Fam Врач. 76 (12): 1795–802. PMID 18217518.
- ^ а б Пицак М.М. (2014). «БАДы при глютеновой болезни». В Rampertab SD, Mullin GE (ред.). Глютеновая болезнь. С. 137–59. ISBN 978-1-4614-8559-9.
- ^ Каннингем-Рандлс C (сентябрь 2001 г.). «Физиология дефицита IgA и IgA». J. Clin. Иммунол. 21 (5): 303–9. Дои:10.1023 / А: 1012241117984. PMID 11720003. S2CID 13285781.
- ^ а б Маркс Дж., Шустер С., Уотсон А. Дж. (1966). «Изменения тонкой кишки при герпетиформном дерматите». Ланцет. 2 (7476): 1280–2. Дои:10.1016 / S0140-6736 (66) 91692-8. PMID 4163419.
- ^ Николас М.Э., Краузе П.К., Гибсон Л.Э., Мюррей Дж. А. (август 2003 г.). «Герпетиформный дерматит». Int. J. Dermatol. 42 (8): 588–600. Дои:10.1046 / j.1365-4362.2003.01804.x. PMID 12890100. S2CID 42280769.
- ^ а б Tersigni C, Castellani R, de Waure C, Fattorossi A, De Spirito M, Gasbarrini A, Scambia G, Di Simone N (2014). «Целиакия и репродуктивные расстройства: метаанализ эпидемиологических ассоциаций и потенциальных патогенетических механизмов». Обновление репродукции человека. 20 (4): 582–93. Дои:10.1093 / humupd / dmu007. PMID 24619876.
- ^ Фергюсон А., Хаттон М.М., Максвелл Д.Д., Мюррей Д. (1970). «Глютеновая болезнь взрослых у пациентов с гипоспелезом». Ланцет. 1 (7639): 163–4. Дои:10.1016 / S0140-6736 (70) 90405-8. PMID 4189238.
- ^ Купфер СС, Джабри Б. (2012). «Патофизиология целиакии». Гастроинтест Endosc Clin N Am (Обзор). 22 (4): 639–60. Дои:10.1016 / j.giec.2012.07.003. ЧВК 3872820. PMID 23083984.
Глютен включает два разных типа белков, глиадины и глютенины, способные вызывать заболевание.
- ^ а б c d Biesiekierski, Джессика R (2017). "Что такое глютен?". Журнал гастроэнтерологии и гепатологии. 32: 78–81. Дои:10.1111 / jgh.13703. PMID 28244676. S2CID 6493455.
Белки, похожие на глиадин, содержащийся в пшенице, существуют как секалин в ржи, гордеин в ячмене и авенины в овсе и вместе называются «глютеном». Производные этих зерен, такие как тритикале и солод, и другие древние сорта пшеницы, такие как полба и камут, также содержат глютен. Глютен, содержащийся во всех этих зернах, был идентифицирован как компонент, способный вызвать иммуно-опосредованное расстройство, глютеновую болезнь.
- ^ а б c d Куппер C (2005). «Диетические рекомендации и выполнение при глютеновой болезни». Гастроэнтерология. 128 (4 Приложение 1): S121–7. Дои:10.1053 / j.gastro.2005.02.024. PMID 15825119.
- ^ а б Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (18 ноября 2013 г.). «Безглютеновая диета у детей: подход к полноценному и сбалансированному питанию». Питательные вещества. 5 (11): 4553–65. Дои:10.3390 / nu5114553. ЧВК 3847748. PMID 24253052.
- ^ а б de Souza MC, Deschênes ME, Laurencelle S, Godet P, Roy CC, Djilali-Saiah I (2016). «Чистый овес как часть канадской безглютеновой диеты при глютеновой болезни: необходимость пересмотреть проблему». Может J Гастроэнтерол Гепатол (Обзор). 2016: 1–8. Дои:10.1155/2016/1576360. ЧВК 4904650. PMID 27446824.
- ^ а б Хабуби, Нью-Йорк, Тейлор С., Джонс С. (октябрь 2006 г.). «Целиакия и овес: систематический обзор». Postgrad Med J (Обзор). 82 (972): 672–8. Дои:10.1136 / pgmj.2006.045443. ЧВК 2653911. PMID 17068278.
- ^ Галлахер, Эймер (2009). Наука и технологии в области пищевых продуктов без глютена. Опубликовано John Wiley and Sons. п. 320. ISBN 978-1-4051-5915-9. В архиве из оригинала 17 июня 2009 г.
- ^ «Связь глютена». Министерство здравоохранения Канады. Май 2009 г. В архиве из оригинала 5 июля 2017 г.. Получено 1 октября 2013.
- ^ Пинто-Санчес М.И., Верду Э.Ф., Лю Э., Берчик П., Грин PH, Мюррей Дж.А., Гуандалини С., Моайеди П. (январь 2016 г.). «Введение глютена в кормление младенцев и риск глютеновой болезни: систематический обзор и метаанализ». Журнал педиатрии. 168: 132–43.e3. Дои:10.1016 / j.jpeds.2015.09.032. PMID 26500108.
- ^ Иеродиакону Д., Гарсия-Ларсен В., Логан А., Грум А., Кунха С., Чивинг Дж., Робинсон З., Геогеган Н., Джарролд К., Ривз Т., Тагиева-Милн Н., Нурматов Ю., Тривелла М., Леонарди-Би Дж., Бойл Р. Дж. (Сентябрь 2016 г.). «Сроки введения аллергенных продуктов в рацион младенцев и риск аллергических или аутоиммунных заболеваний: систематический обзор и метаанализ». JAMA. 316 (11): 1181–1192. Дои:10.1001 / jama.2016.12623. HDL:10044/1/40479. PMID 27654604.
- ^ Акобенг А.К., Раманан А.В., Бучан И., Хеллер РФ (январь 2006 г.). «Влияние грудного вскармливания на риск развития целиакии: систематический обзор и метаанализ наблюдательных исследований». Архив детских болезней. 91 (1): 39–43. Дои:10.1136 / adc.2005.082016. ЧВК 2083075. PMID 16287899.
- ^ Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, Barbato M, Barbera C, Barera G, Bellantoni A, Castellano E, Guariso G, Limongelli MG, Pellegrino S, Polloni C, Ughi C, Zuin G , Фазано А, Catassi C (октябрь 2014 г.). «Введение глютена, статуса HLA и риска глютеновой болезни у детей». Медицинский журнал Новой Англии (Сравнительное исследование). 371 (14): 1295–303. Дои:10.1056 / NEJMoa1400697. HDL:2318/155238. PMID 25271602.
- ^ Лонгмор, Мюррей (2014). Оксфордский справочник клинической медицины. Издательство Оксфордского университета. п. 280. ISBN 9780199609628.
- ^ а б c Хадити М., фон Бломберг Б.М., Крузиус Дж. Б., Блумена Э, Костенсе П. Дж., Мейер Дж. В., Малдер С. Дж., Stehouwer CD, Пенья А.С. (2007). «Точность серологических тестов и HLA-DQ-типирования для диагностики целиакии». Анна. Междунар. Med. 147 (5): 294–302. Дои:10.7326/0003-4819-147-5-200709040-00003. PMID 17785484. S2CID 24275278.
- ^ Ким С., Куарстен Х., Бергсенг Э., Хосла С., Соллид Л. (2004). «Структурная основа HLA-DQ2-опосредованной презентации эпитопов глютена при целиакии». Proc Natl Acad Sci USA. 101 (12): 4175–9. Bibcode:2004ПНАС..101.4175К. Дои:10.1073 / pnas.0306885101. ЧВК 384714. PMID 15020763.
- ^ Джорес Р.Д., фрау Ф., Кукка Ф., Грация Клементе М., Орро С., Раис М., Де Вирджилис С., Конгиа М. (2007). «Гомозиготный HLA-DQB1 * 0201 предрасполагает к тяжелому поражению кишечника при целиакии». Сканд. J. Гастроэнтерол. 42 (1): 48–53. Дои:10.1080/00365520600789859. PMID 17190762. S2CID 7675714.
- ^ Карелл К., Лука А.С., Муди С.Дж., Ашер Х., Сгусток Ф., Греко Л., Чиклитира П.Дж., Соллид Л.М., Партанен Дж. (2003). «Типы HLA у пациентов с целиакией, не несущих гетеродимер DQA1 * 05-DQB1 * 02 (DQ2): результаты Европейского генетического кластера по целиакии». Гм. Иммунол. 64 (4): 469–77. Дои:10.1016 / S0198-8859 (03) 00027-2. PMID 12651074.
- ^ Михальский JP, Маккомбс CC, Араи Т., Элстон Р.С., Цао Т., Маккарти С.Ф., Стивенс FM (1996). «Генотипы HLA-DR, DQ пациентов с целиакией и здоровых людей из Западной Ирландии». Тканевые антигены. 47 (2): 127–33. Дои:10.1111 / j.1399-0039.1996.tb02525.x. PMID 8851726.
- ^ Каур Г., Саркар Н., Бхатнагар С., Кумар С., Rapthap CC, Бхан М.К., Мехра Н.К. (2002). «Детская глютеновая болезнь в Индии связана с множественными гаплотипами DR3-DQ2». Гм. Иммунол. 63 (8): 677–82. Дои:10.1016 / S0198-8859 (02) 00413-5. PMID 12121676.
- ^ Layrisse Z, Guedez Y, Domínguez E, Paz N, Montagnani S, Matos M, Herrera F, Ogando V, Balbas O, Rodríguez-Larralde A (2001). «Расширенные гаплотипы HLA в популяции карибских индейцев: Юкпа хребта Периджа». Hum Immunol. 62 (9): 992–1000. Дои:10.1016 / S0198-8859 (01) 00297-X. PMID 11543901.
- ^ а б Dubois PC, Trynka G, Franke L, Hunt KA, Romanos J, Curtotti A, Zhernakova A, Heap GA, Adány R, Aromaa A, Bardella MT, van den Berg LH, Bockett NA, de la Concha EG, Dema B, Fehrmann RS, Фернандес-Аркуеро М, Фиатал С, Грандоне Э, Грин ПМ, Гроен Х.Дж., Гвиллиам Р., Хоувен Р.Х., Хант С.Е., Каукинен К., Келлехер Д., Корпонай-Сабо I, Курппа К., Макматуна П., Маки М, Маззилли М.С. , McCann OT, Mearin ML, Mein CA, Mirza MM, Mistry V, Mora B, Morley KI, Mulder CJ, Murray JA, Núñez C, Oosterom E, Ophoff RA, Polanco I, Peltonen L, Platteel M, Rybak A, Salomaa V, Schweizer JJ, Сперандео М.П., Tack GJ, Turner G, Veldink JH, Verbeek WH, Weersma RK, Wolters VM, Urcelay E, Cukrowska B, Greco L, Neuhausen SL, McManus R, Barisani D, Deloukas P, Barrett JC, Саавалайнен П., Вейменга С., Ван Хеель Д.А. (2010). «Множественные распространенные варианты целиакии, влияющие на экспрессию иммунных генов». Природа Генетика. 42 (4): 295–302. Дои:10,1038 / нг.543. ЧВК 2847618. PMID 20190752.
- ^ Вальхер Д. Н., Кретчмер Н. (1981). Еда, питание и эволюция: пища как фактор окружающей среды в генезисе человеческой изменчивости. Доклады, представленные на Международном конгрессе Международной организации по изучению человеческого развития, Masson Pub. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. С. 179–199. ISBN 978-0-89352-158-5.
- ^ Катасси С (2005). «Откуда глютеновая болезнь и почему?». Журнал детской гастроэнтерологии и питания. 40 (3): 279–282. Дои:10.1097 / 01.MPG.0000151650.03929.D5. PMID 15735480. S2CID 12843113.
- ^ Жернакова А., Эльберс С.К., Ферверда Б., Романос Дж., Трынка Г., Дюбуа П.К., де Ковель К.Г., Франке Л., Остинг М., Барисани Д., Барделла М.Т., Йустен Л.А., Саавалайнен П., ван Хеель Д.А., Катасси С., Нетеа М.Г., Вейменга C (2010). «Эволюционный и функциональный анализ локусов глютенового риска показывает, что SH2B3 является защитным фактором против бактериальной инфекции». Американский журнал генетики человека. 86 (6): 970–7. Дои:10.1016 / j.ajhg.2010.05.004. ЧВК 3032060. PMID 20560212.
- ^ Зеленый PH, Селье С (2007). «Целиакия». N. Engl. J. Med. 357 (17): 1731–43. Дои:10.1056 / NEJMra071600. PMID 17960014.
- ^ Ламмерс К.М., Лу Р., Браунли Дж., Лу Б., Джерард С., Томас К., Раллабанди П., Ши-Донохью Т., Тамиз А., Алкан С., Нетцель-Арнетт С., Анталис Т., Фогель С. Н., Фазано А. (2008). «Глиадин вызывает увеличение кишечной проницаемости и высвобождение зонулина за счет связывания с хемокиновым рецептором CXCR3». Гастроэнтерология. 135 (1): 194–204.e3. Дои:10.1053 / j.gastro.2008.03.023. ЧВК 2653457. PMID 18485912.
- ^ а б Цяо С.В., Бергсенг Э., Мольберг Ø и др. (Август 2004 г.). «Презентация антигена Т-клеткам, полученным из глютенового поражения, 33-мерного пептида глиадина, естественно образующегося в результате желудочно-кишечного пищеварения». J. Immunol. 173 (3): 1757–62. Дои:10.4049 / jimmunol.173.3.1757. PMID 15265905. S2CID 24910686.
- ^ Шань Л., Цяо С.В., Арентц-Хансен Х., Мольберг Э., Грей Г.М., Соллид Л.М., Хосла С. (2005). «Идентификация и анализ поливалентных протеолитически устойчивых пептидов из глютена: последствия для глютенового спру». J. Proteome Res. 4 (5): 1732–41. Дои:10.1021 / pr050173t. ЧВК 1343496. PMID 16212427.
- ^ а б Сковбьерг Х., Норен О, Антонсен Д., Моллер Дж., Сьёстрём Х. (2002). «Глиадин является хорошим субстратом для нескольких трансглютаминаз: возможное участие в патогенезе целиакии». Сканд Дж Гастроэнтерол. 37 (7): 812–7. Дои:10.1080/713786534. PMID 12190095.
- ^ Fleckenstein B, Molberg Ø, Qiao SW, Schmid DG, von der Mülbe F, Elgstøen K, Jung G, Sollid LM (2002). «Отбор Т-клеточного эпитопа глиадина тканевой трансглутаминазой при глютеновой болезни. Роль ферментативной специфичности и влияния pH на процесс трансамидирования по сравнению с процессом деамидирования». J Biol Chem. 277 (37): 34109–34116. Дои:10.1074 / jbc.M204521200. PMID 12093810. S2CID 7102008.
- ^ Конинг Ф., Шуппан Д., Серф-Бенсуссан Н., Соллид Л. М. (июнь 2005 г.). «Патомеханизмы при целиакии». Лучшие практики и исследования. Клиническая гастроэнтерология. 19 (3): 373–387. Дои:10.1016 / j.bpg.2005.02.003. ISSN 1521-6918. PMID 15925843.
- ^ Моват AM (2003). «Целиакия - место встречи генетики, иммунологии и химии белков». Ланцет. 361 (9365): 1290–1292. Дои:10.1016 / S0140-6736 (03) 12989-3. PMID 12699968. S2CID 10259661.
- ^ Дьюар Д., Перейра С.П., Циклитира П.Дж. (2004). «Патогенез целиакии». Int J Biochem Cell Biol. 36 (1): 17–24. Дои:10.1016 / S1357-2725 (03) 00239-5. PMID 14592529.
- ^ Каукинен К., Перяхо М., Коллин П., Партанен Дж., Вулли Н., Каартинен Т., Нуутинен Т., Халттунен Т., Мяки М., Корпонай-Сабо И. (2005). «Отложения IgA-специфических транглутаминазы 2 слизистой оболочки тонкой кишки при целиакии без атрофии ворсинок: проспективное и радмонизированное клиническое исследование». Сканд Дж Гастроэнтерол. 40 (5): 564–572. Дои:10.1080/00365520510023422. PMID 16036509. S2CID 27068601.
- ^ Салми Т.Т., Коллин П., Корпонай-Сабо И.Р., Лаурила К., Партанен Дж., Хухтала Х., Кирали Р., Лоранд Л., Реунала Т., Маки М., Каукинен К. (2006). «Эндомизиальная целиакия без антител: клинические характеристики и отложения аутоантител в кишечнике». Кишечник. 55 (12): 1746–53. Дои:10.1136 / gut.2005.071514. ЧВК 1856451. PMID 16571636.
- ^ Londei M, Ciacci C, Ricciardelli I, Vacca L, Quaratino S, Maiuri L (2005). «Глиадин как стимулятор врожденных реакций при глютеновой болезни». Мол Иммунол. 42 (8): 913–918. Дои:10.1016 / j.molimm.2004.12.005. PMID 15829281.
- ^ Занони Г., Навоне Р., Лунарди С., Триденте Г., Бейсон С., Сивори С., Бери Р., Дольчино М., Валлетта Е., Коррочер Р., Пуччетти А. (2006). «При целиакии подгруппа аутоантител против трансглутаминазы связывает толл-подобный рецептор 4 и вызывает активацию моноцитов». PLOS Med. 3 (9): e358. Дои:10.1371 / journal.pmed.0030358. ЧВК 1569884. PMID 16984219.
- ^ Салим А.Ф., Филлипс А.Д., Фартинг М.Дж. (1990). «Патогенез кишечной вирусной инфекции». Клиническая гастроэнтерология Байера. 4 (3): 593–607. Дои:10.1016 / 0950-3528 (90) 90051-Н. ЧВК 7172617. PMID 1962725.
- ^ «Целиакия: обзор». BCMJ. 43 (7): 390–395. Сентябрь 2001. Архивировано с оригинал 22 февраля 2014 г.. Получено 15 февраля 2014.
- ^ а б c d ван дер Виндт Д.А., Джеллема П., Малдер С.Дж., Кнепкенс К.М., ван дер Хорст Х.Э. (2010). «Диагностическое тестирование целиакии среди пациентов с абдоминальными симптомами: систематический обзор». JAMA. 303 (17): 1738–46. Дои:10.1001 / jama.2010.549. PMID 20442390.
В большинстве исследований использовались аналогичные гистологические критерии для диагностики целиакии (степень тяжести ≥III по Маршу), но уровень повреждения может варьироваться в зависимости от популяции. Только 4 исследования представили долю пациентов, у которых была обнаружена только частичная атрофия ворсинок (степень IIIA по Маршу), которая варьировала от 4% до 100%. Было показано, что наличие положительных сывороточных антител коррелирует со степенью атрофии ворсинок, а пациенты с глютеновой болезнью и менее тяжелыми гистологическими повреждениями могут иметь серонегативные результаты. Это может быть важно, особенно в первичной медико-санитарной помощи, где уровни повреждения слизистой оболочки могут быть ниже, и, следовательно, может быть пропущено больше пациентов с глютеновой болезнью.
- ^ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T. (2000). «Человеческая рекомбинантная тканевая трансглутаминаза ELISA: инновационный диагностический тест на целиакию». Am. J. Gastroenterol. 95 (5): 1253–57. PMID 10811336.
- ^ Корпонай-Сабо И.Р., Дальбом И., Лаурила К., Коскинен С., Вулли Н., Партанен Дж., Ковач Дж. Б., Мяки М., Ханссон Т. (2003). «Повышение уровня антител IgG к тканевой трансглутаминазе как средство диагностики целиакии при селективном дефиците IgA». Кишечник. 52 (11): 1567–71. Дои:10.1136 / гут.52.11.1567. ЧВК 1773847. PMID 14570724.
- ^ а б Hill ID, Диркс М.Х., Липтак Г.С., Коллетти Р.Б., Фазано А., Гуандалини С., Хоффенберг Э. Дж., Хорват К., Мюррей Дж. А., Пивор М., Зейдман Э. Г. (2005). «Руководство по диагностике и лечению целиакии у детей: рекомендации Североамериканского общества педиатрической гастроэнтерологии, гепатологии и питания». J. Pediatr. Гастроэнтерол. Nutr. 40 (1): 1–19. Дои:10.1097/00005176-200501000-00001. PMID 15625418. S2CID 14805217.
- ^ а б Hill ID (апрель 2005 г.). «Какова чувствительность и специфичность серологических тестов на целиакию? Различаются ли чувствительность и специфичность в разных популяциях?» (PDF). Гастроэнтерология. 128 (4 Дополнение 1): S25–32. Дои:10.1053 / j.gastro.2005.02.012. PMID 15825123. В архиве (PDF) из оригинала 14 апреля 2007 г.
- ^ Нандивада С.Л., Тебо А.Е. (апрель 2013 г.). «Тестирование на антитела к ретикулину у пациентов с глютеновой болезнью устарело: обзор рекомендаций по серологическому скринингу и литературы». Clin. Вакцина Иммунол. 20 (4): 447–51. Дои:10.1128 / CVI.00568-12. ЧВК 3623418. PMID 23365209.
- ^ Вонг Р.К., Стил Р.Х., Ривз Г.Е., Уилсон Р.Дж., Pink A, Adelstein S (2003). «Антитела и генетическое тестирование при целиакии». Патология. 35 (4): 285–304. Дои:10.1080/00313020307527. PMID 12959764.
- ^ Fagoonee S, De Luca L, De Angelis C, Castelli A, Rizzetto M, Pellicano R (март 2009 г.). «Anti-Saccharomyces cerevisiae как необычные антитела при аутоиммунном гепатите». Минерва Gastroenterologica e Dietologica. 55 (1): 37–40. PMID 19212306.
- ^ Нивелони С., Фиорини А., Дези Р., Педрейра С., Смекуол Э, Васкес Х., Кабанне А., Бурр Л. А., Валеро Дж., Коган З., Мауриньо Е., Бай Дж. К. (1998). «Полезность видеодуоденоскопии и окрашивания витальным красителем как индикаторов атрофии слизистой оболочки при целиакии: оценка согласия между наблюдателями». Эндоскопия желудочно-кишечного тракта. 47 (3): 223–29. Дои:10.1016 / S0016-5107 (98) 70317-7. PMID 9580349.
- ^ Ми А.С., Берк М., Валлон А.Г., Ньюман Дж., Коттон П.Б. (1985). «Биопсия тонкой кишки при мальабсорбции: сравнение диагностической адекватности эндоскопических щипцов и образцов капсульной биопсии». BMJ. 291 (6498): 769–72. Дои:10.1136 / bmj.291.6498.769. ЧВК 1417146. PMID 3929934.
- ^ Редондо-Сересо Е., Санчес-Капилья А. Д., Де Ла Торре-Рубио П., Де Тереза Дж. (Ноябрь 2014 г.). «Беспроводная капсульная эндоскопия: перспективы за пределами желудочно-кишечного кровотечения». Мир J. Gastroenterol. 20 (42): 15664–73. Дои:10.3748 / wjg.v20.i42.15664. ЧВК 4229531. PMID 25400450.
- ^ Марш М.Н. (1992). «Глютен, главный комплекс гистосовместимости и тонкий кишечник. Молекулярный и иммунобиологический подход к спектру чувствительности к глютену (« чревный спру »)». Гастроэнтерология. 102 (1): 330–54. Дои:10.1016 / 0016-5085 (92) 91819-п. PMID 1727768.
- ^ Корацца Г.Р., Вилланаччи V (1 июня 2005 г.). "Глютеновая болезнь". J. Clin. Патол. 58 (6): 573–74. Дои:10.1136 / jcp.2004.023978. ЧВК 1770677. PMID 15917404.
- ^ Оберхубер G, Granditsch G, Vogelsang H (октябрь 1999 г.). «Гистопатология целиакии: время для стандартизированной схемы отчета для патологов». Евро. J. Gastroenterol. Гепатол. 11 (10): 1185–94. Дои:10.1097/00042737-199910000-00019. PMID 10524652.
- ^ Корацца Г.Р., Вилланаччи В., Замбелли С., Милионе М., Луинетти О, Виндини С., Чиода С., Альбарелло Л., Бартолини Д., Донато Ф. (2007). «Сравнение воспроизводимости результатов между наблюдателями с различными гистологическими критериями, используемыми при целиакии». Clin. Гастроэнтерол. Гепатол. 5 (7): 838–43. Дои:10.1016 / j.cgh.2007.03.019. PMID 17544877.
- ^ Онтиверос Н., Харди М.Ю., Кабрера-Чавес Ф (2015). «Оценка глютеновой болезни и нечувствительности к глютену». Гастроэнтерологические исследования и практика (Обзор). 2015: 1–13. Дои:10.1155/2015/723954. ЧВК 4429206. PMID 26064097.
- ^ Genuis SJ, Lobo RA (2014). «Чувствительность к глютену, проявляющаяся как нервно-психическое расстройство». Гастроэнтерол Рес Прак (Обзор). 2014: 293206. Дои:10.1155/2014/293206. ЧВК 3944951. PMID 24693281.
- ^ Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard JN, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C (январь 2013 г.) ). «Определения глютеновой болезни и связанных с ней терминов, принятые в Осло». Кишечник. 62 (1): 43–52. Дои:10.1136 / gutjnl-2011-301346. ЧВК 3440559. PMID 22345659.
- ^ Элли Л., Ронкорони Л., Барделла М. Т. (июль 2015 г.). «Чувствительность к глютену без глютена: время просеять зерна». Мир Дж Гастроэнтерол (Обзор). 21 (27): 8221–6. Дои:10.3748 / wjg.v21.i27.8221. ЧВК 4507091. PMID 26217073.
- ^ Фазано А., Сапоне А., Зеваллос В., Шуппан Д. (май 2015 г.). «Неколиевая чувствительность к глютену». Гастроэнтерология (Обзор). 148 (6): 1195–204. Дои:10.1053 / j.gastro.2014.12.049. PMID 25583468.
- ^ а б Кастильо, NE, Theethira TG, Leffler DA (февраль 2015 г.). «Настоящее и будущее в диагностике и лечении целиакии». Гастроэнтерологический отчет (Обзор). 3 (1): 3–11. Дои:10.1093 / gastro / gou065. ЧВК 4324867. PMID 25326000.
- ^ а б c d е Леви Дж, Бернштейн Л., Зильбер Н. (декабрь 2014 г.). «Целиакия: синдром иммунной дисрегуляции». Актуальные проблемы охраны здоровья детей и подростков (Обзор). 44 (11): 324–7. Дои:10.1016 / j.cppeds.2014.10.002. PMID 25499458.
Первоначально снижение уровня активности лактазы и сахаразы может потребовать дальнейших диетических ограничений до тех пор, пока ворсинки не заживут и эти сахара не станут лучше переноситься.
- ^ а б c d Монтальто М., Галло А., Охетти В., Гасбаррини А. (2013). «Мальабсорбция фруктозы, трегалозы и сорбита» (PDF). Европейский обзор медицинских и фармакологических наук (Обзор). 17 Дополнение 2 (Дополнение 2): 26–9. PMID 24443064. В архиве (PDF) из оригинала 12 апреля 2016 г.
- ^ а б Леффлер Д.А., Грин PH, Фазано А (октябрь 2015 г.). «Внекишечные проявления целиакии». Обзоры природы. Гастроэнтерология и гепатология (Обзор). 12 (10): 561–71. Дои:10.1038 / nrgastro.2015.131. PMID 26260366. S2CID 15561525.
- ^ а б c d е ж г час я Вудворд Дж. (3 августа 2016 г.). «Улучшение результатов рефрактерной целиакии - текущие и новые стратегии лечения». Клиническая и экспериментальная гастроэнтерология (Обзор). 9: 225–36. Дои:10.2147 / ceg.s87200. ЧВК 4976763. PMID 27536154.
- ^ а б c Берни Канани Р., Пеццелла В., Аморосо А., Коццолино Т., Ди Скала С., Пассариелло А. (март 2016 г.). «Диагностика и лечение непереносимости углеводов у детей». Питательные вещества. 8 (3): 157. Дои:10.3390 / nu8030157. ЧВК 4808885. PMID 26978392.
- ^ а б c Гарсия-Мансанарес А., Лусендо А.Дж. (апрель 2011 г.). «Пищевые и диетические аспекты целиакии». Питание в клинической практике (Обзор). 26 (2): 163–73. Дои:10.1177/0884533611399773. PMID 21447770.
- ^ а б c d Зеленый PH, Джабри Б. (август 2003 г.). "Глютеновая болезнь". Ланцет (Обзор). 362 (9381): 383–91. Дои:10.1016 / S0140-6736 (03) 14027-5. PMID 12907013. S2CID 39188931.
- ^ Volta U, Caio G, Tovoli F, De Giorgio R (сентябрь 2013 г.). «Чувствительность к глютену без целиакии: вопросы, на которые еще предстоит ответить, несмотря на растущее понимание». Клеточная и молекулярная иммунология (Обзор). 10 (5): 383–92. Дои:10,1038 / cmi.2013.28. ЧВК 4003198. PMID 23934026.
- ^ Национальный институт здравоохранения и клинического совершенства. Клиническое руководство 53: Синдром хронической усталости / миалгический энцефаломиелит. Лондон, 2007 год.
- ^ Murch S, Jenkins H, Auth M, Bremner R, Butt A, France S, Furman M, Gillett P, Kiparissi F, Lawson M, McLain B, Morris MA, Sleet S, Thorpe M (октябрь 2013 г.). «Совместное руководство BSPGHAN и Celiac UK по диагностике и лечению целиакии у детей». Архив детских болезней. 98 (10): 806–11. Дои:10.1136 / archdischild-2013-303996. PMID 23986560. S2CID 30417933.
- ^ Хан И, Чен В, Ли П, Йе Дж (2015). «Связь между глютеновой болезнью и риском любого злокачественного новообразования и злокачественных новообразований желудочно-кишечного тракта: метаанализ». Медицина (Балтимор) (Мета-анализ). 94 (38): e1612. Дои:10.1097 / MD.0000000000001612. ЧВК 4635766. PMID 26402826.
- ^ а б Чаччо Э.Дж., Льюис С.К., Бивиано А.Б., Айер В., Гаран Х., Зеленый PH (2017). «Поражение сердечно-сосудистой системы при целиакии». Мир Дж Кардиол (Обзор). 9 (8): 652–666. Дои:10.4330 / wjc.v9.i8.652. ЧВК 5583538. PMID 28932354.
- ^ Treem WR (2004). «Новые концепции в целиакии». Curr Opin Pediatr. 16 (5): 552–9. Дои:10.1097 / 01.mop.0000142347.74135.73. PMID 15367850. S2CID 20221260.
- ^ Ли А.Р., Нг Д.Л., Зивин Дж., Зеленый PH (2007). «Экономическое бремя безглютеновой диеты» (PDF). Диета J Hum Nutr. 20 (5): 423–30. CiteSeerX 10.1.1.662.8399. Дои:10.1111 / j.1365-277X.2007.00763.x. PMID 17845376. Архивировано из оригинал (PDF) 24 июня 2015 г.. Получено 9 февраля 2018.
- ^ Troncone R, Ivarsson A, Szajewska H, Mearin ML (2008). «Обзорная статья: будущие исследования целиакии - отчет о позиции Европейской платформы с участием многих заинтересованных сторон по целиакии (CDEUSSA)». Алимент. Pharmacol. Ther. 27 (11): 1030–43. Дои:10.1111 / j.1365-2036.2008.03668.x. PMID 18315588. S2CID 30241867.
- ^ а б Акобенг А.К., Томас А.Г. (июнь 2008 г.). «Систематический обзор: допустимое количество глютена для людей с глютеновой болезнью». Алимент. Pharmacol. Ther. 27 (11): 1044–52. Дои:10.1111 / j.1365-2036.2008.03669.x. PMID 18315587. S2CID 20539463.
- ^ «Безглютеновая пища». Главное управление здравоохранения и потребителей. В архиве из оригинала 23 июля 2015 г.. Получено 25 июля 2015.
- ^ «Что такое безглютеновый? У FDA есть ответ». Управление по контролю за продуктами и лекарствами. 2 августа 2013 г. В архиве из оригинала от 4 августа 2013 г.. Получено 2 августа 2013.
В качестве одного из критериев для использования заявления «без глютена» FDA устанавливает предел содержания глютена менее 20 частей на миллион (частей на миллион) в продуктах, отмеченных этой этикеткой. Это самый низкий уровень, который можно постоянно обнаруживать в пищевых продуктах с помощью надежных научных аналитических инструментов. Кроме того, большинство людей с глютеновой болезнью могут переносить продукты с очень небольшим содержанием глютена. Этот уровень соответствует уровням, установленным другими странами и международными организациями, которые устанавливают стандарты безопасности пищевых продуктов.
- ^ Раздел 206 Закона о маркировке пищевых аллергенов и защите потребителей 2004 г., раздел II Pub.L. 108–282 (текст) (pdf), 118 Стат. 891 , введен в действие 2 августа 2004 г.
- ^ 78 FR 47154 (5 августа 2013 г.). Зашифровано в 21 C.F.R. 101.91.
- ^ «Текущие официальные стандарты». ФАО / ВОЗ. Архивировано из оригинал 4 июня 2011 г.
- ^ Андерсон, Джейн. «Сертифицированные продукты без глютена: что означает сертификация без глютена для потребителей?». About.com. В архиве из оригинала 12 апреля 2014 г.. Получено 4 марта 2014.
- ^ Burger JP, де Брауэр Б., IntHout J, Wahab PJ, Tummers M, Drenth JP (апрель 2017 г.). «Систематический обзор с метаанализом: соблюдение диеты влияет на нормализацию связанного со здоровьем качества жизни при целиакии». Клиническое питание. 36 (2): 399–406. Дои:10.1016 / j.clnu.2016.04.021. PMID 27179800.
- ^ Малдер CJ, ван Ванрой Р.Л., Баккер С.Ф., Wierdsma N, Bouma G (2013). «Безглютеновая диета при расстройствах, связанных с глютеном». Копать землю. Dis. (Обзор). 31 (1): 57–62. Дои:10.1159/000347180. PMID 23797124. S2CID 14124370.
- ^ а б c Лебволь Б., Людвигссон Дж. Ф., Грин PH (октябрь 2015 г.). «Целиакия и непереносимость глютена». BMJ. 351: h4347. Дои:10.1136 / bmj.h4347. ЧВК 4596973. PMID 26438584.
- ^ Rewers M (апрель 2005 г.). «Эпидемиология целиакии: каковы распространенность, частота и прогрессирование целиакии?» (PDF). Гастроэнтерология. 128 (4 Дополнение 1): S47–51. Дои:10.1053 / j.gastro.2005.02.030. PMID 15825126. В архиве (PDF) из оригинала 14 апреля 2007 г.
- ^ Гуандалини С., Ассири А. (март 2014 г.). «Целиакия: обзор». JAMA Педиатрия. 168 (3): 272–8. Дои:10.1001 / jamapediatrics.2013.3858. PMID 24395055.
- ^ Катасси С., Рэтч И.М., Гандольфи Л., Пратеси Р., Фабиани Э., Эль-Асмар Р., Фрихия М., Беарци И., Виццони Л. (август 1999 г.). «Почему целиакия является эндемической у жителей Сахары?». Ланцет. 354 (9179): 647–8. Дои:10.1016 / S0140-6736 (99) 02609-4. PMID 10466670. S2CID 9242679.
- ^ «Целиакия - целиакия в Австралии». www.coeliac.org.au. Получено 8 мая 2019.
- ^ Хулстон РС, Форд Д (1996). «Генетика целиакии». QJM. 89 (10): 737–43. Дои:10.1093 / qjmed / 89.10.737. PMID 8944229.
- ^ Бьюкенен Н. (1987). Здоровье детей и подростков для практикующих врачей. Уильямс и Уилкинс. п. 164. ISBN 978-0-86433-015-4.
- ^ Ципсер Р.Д., Фарид М., Байш Д., Пател Б., Пател Д. (2005). «Осведомленность врачей о целиакии: необходимость дальнейшего образования». J Gen Intern Med. 20 (7): 644–6. Дои:10.1007 / s11606-005-0111-7. ЧВК 1490146. PMID 16050861.
- ^ а б Баркер Дж. М., Лю Э. (2008). «Целиакия: патофизиология, клинические проявления и ассоциированные аутоиммунные состояния». Адв Педиатр. 55: 349–65. Дои:10.1016 / j.yapd.2008.07.001. ЧВК 2775561. PMID 19048738.
- ^ Лидс Дж. С., Хоппер А. Д., Сандерс Д. С. (2008). "Глютеновая болезнь". Br Med Bull. 88 (1): 157–70. Дои:10.1093 / bmb / ldn044. PMID 19073695.
- ^ а б Оксентенко А.С.; Рубио-Тапиа, А (декабрь 2019 г.). «Целиакия». Труды клиники Мэйо. 94 (12): 2556–2571. Дои:10.1016 / j.mayocp.2019.02.019. PMID 31806106.
- ^ а б c Адамс Ф., переводчик (1856 г.). "О килиакской привязанности". Сохранившиеся работы Аретея, Каппадокийца. Лондон: Общество Сиденхэма. стр. 350–1. Получено 12 декабря 2009.
- ^ а б c d е ж Лозовский М.С. (2008). «История глютеновой болезни». Пищеварительные заболевания. 26 (2): 112–20. Дои:10.1159/000116768. PMID 18431060. S2CID 10062937.
- ^ Джи, SJ (1888). «О чревной болезни». Отчет больницы Святого Варфоломея. 24: 17–20. Архивировано из оригинал 26 сентября 2007 г.. Получено 20 марта 2007.
- ^ Гертер, Калифорния (1908). Об инфантилизме от хронической кишечной инфекции; характеризуется чрезмерным ростом и сохранением флоры в период кормления. Нью-Йорк: Macmillan & Co. цитируется WhoNamedIt
- ^ Enersen OD. "Кристиан Арчибальд Гертер". Кто это назвал ?. В архиве с оригинала 31 декабря 2006 г.. Получено 20 марта 2007.
- ^ Хаас С.В. (1924). «Значение банана в лечении целиакии». Am J Dis Child. 24 (4): 421–37. Дои:10.1001 / архпеди.1924.04120220017004.
- ^ ван Берге-Хенегувен Г.П., Малдер С.Дж. (1993). «Пионер безглютеновой диеты: Виллем-Карел Дике 1905–1962, более 50 лет безглютеновой диеты». Кишечник. 34 (11): 1473–5. Дои:10.1136 / гут.34.11.1473. ЧВК 1374403. PMID 8244125.
- ^ Дике В.К. (1950). Coeliakie: een onderzoek naar de nadelige invloed van sommige graansoorten op de lijder aan coeliakie, кандидатская диссертация (на голландском). Утрехт, Нидерланды: Утрехтский университет.
- ^ Фазано А (2009). "Информация о целиакии: ключи к решению аутоиммунных заболеваний". Scientific American (Август): 49–57. В архиве из оригинала от 8 февраля 2010 г.
- ^ Андерсон CM, Френч JM, Sammons HG, Frazer AC, Gerrard JW, Smellie JM (1952). «Целиакия; исследования желудочно-кишечного тракта и влияние диетической пшеничной муки». Ланцет. 1 (17): 836–42. Дои:10.1016 / S0140-6736 (52) 90795-2. PMID 14918439.
- ^ Полли Дж. В. (1954). «Наблюдение за этиологией идиопатической стеатореи; биопсия тощей кишки и лимфатических узлов». Br Med J. 2 (4900): 1318–21. Дои:10.1136 / bmj.2.4900.1318. ЧВК 2080246. PMID 13209109.
- ^ Макдональд WC, Доббинс WO, Рубин CE (1965). «Исследования семейной природы глютенового спру с использованием биопсии тонкой кишки». N Engl J Med. 272 (9): 448–56. Дои:10.1056 / NEJM196503042720903. PMID 14242522.
- ^ «Купи мне арахис без глютена, крекеры». Журнал QSR. Журналистский. 11 мая 2010 г. В архиве из оригинала 4 декабря 2011 г.. Получено 30 декабря 2010.
- ^ Хиллсон, Бет (9 января 2008 г.). «Май как месяц осведомленности о целиакии». Фонд по глютеновой болезни. Архивировано из оригинал 24 февраля 2010 г.. Получено 1 июля 2011.
- ^ На одном онлайн-сайте продается 1200 вафель общим весом 523 г. В архиве 16 сентября 2011 г. Wayback Machine. Eden.co.uk (31 июля 2013 г.). Проверено 3 сентября 2013 г.
- ^ Заявление Национальной конференции католических епископов об использовании продуктов с низким содержанием глютена на мессе В архиве 16 июля 2013 г. Wayback Machine. Информационный бюллетень BCL. Ноябрь 2003 г.
- ^ «Девушке с заболеванием пищеварения отказано в причастии». Новости NBC. Microsoft. Ассошиэйтед Пресс. 8 декабря 2004 г.. Получено 30 мая 2006.
- ^ Ратцингер, Джозеф (24 июля 2003 г.). Prot. 89 / 78-174 98. Конгрегация Доктрины Веры. Полный текст: «Использование мустума и продуктов с низким содержанием глютена при мессе». Информационный бюллетень BCL. Конференция католических епископов США. Ноябрь 2003 г. В архиве из оригинала от 2 января 2007 г.. Получено 7 марта 2007.
- ^ Макнамара, отец Эдвард (15 сентября 2004 г.). «Литургия: хозяева без глютена». Католический Интернет. В архиве из оригинала 29 сентября 2007 г.. Получено 17 июн 2007.
- ^ Миллуорд, Дэвид (8 июля 2017 г.). «Ватикан запрещает использование хлеба без глютена для Святого Причастия». Телеграф. В архиве из оригинала 4 августа 2017 г.. Получено 3 августа 2017.
- ^ Определение "CELIAC DISEASE | в кембриджском словаре английского языка". Dictionary.cambridge.org. Получено 15 декабря 2018.
- ^ "Целиакия против целиакии". www.glutenfreedublin.com. Получено 15 декабря 2018.
- ^ Kemppainen KM, Lynch KF, Liu E, Lönnrot M, Simell V, Briese T. и др. (Май 2017). «Факторы, повышающие риск аутоиммунитета к целиакии после желудочно-кишечной инфекции в раннем возрасте». Клиническая гастроэнтерология и гепатология. 15 (5): 694–702.e5. Дои:10.1016 / j.cgh.2016.10.033. ЧВК 5576726. PMID 27840181.
- ^ Verdu EF, Caminero A (апрель 2017 г.). «Как инфекция может вызвать чувствительность к пище». Наука. 356 (6333): 29–30. Bibcode:2017Наука ... 356 ... 29В. Дои:10.1126 / science.aan1500. PMID 28385972. S2CID 206659081.
- ^ Freeman HJ (ноябрь 2013 г.). «Недиетические формы лечения целиакии у взрослых». Всемирный журнал желудочно-кишечной фармакологии и терапии (Обзор). 4 (4): 108–12. Дои:10.4292 / wjgpt.v4.i4.108. ЧВК 3817285. PMID 24199026.
- ^ Ванга Р.Р., Келли С.П. (май 2014 г.). «Новые терапевтические подходы к целиакии». Открытие медицины. 17 (95): 285–93. PMID 24882720.
- ^ а б Кастильо, NE, Theethira TG, Leffler DA (2015). «Настоящее и будущее в диагностике и лечении целиакии». Гастроэнтерологический отчет (Обзор). 3 (1): 3–11. Дои:10.1093 / gastro / gou065. ЧВК 4324867. PMID 25326000.
- ^ "Innovate Biopharmaceuticals". www.innovatebiopharma.com. В архиве из оригинала 18 апреля 2016 г.. Получено 17 апреля 2016.
- ^ а б Буйе Т (2013). «Взаимосвязь аутизма и глютена». Clin Ther (Обзор). 35 (5): 578–83. Дои:10.1016 / j.clinthera.2013.04.011. PMID 23688532.
В настоящее время исследований, направленных на лечение симптомов аутизма с помощью диеты, было недостаточно, чтобы поддержать общее введение безглютеновой или другой диеты для всех детей с аутизмом.
- ^ Мари-Баусет С., Зазпе I, Мари-Санчис А., Ллопис-Гонсалес А., Моралес-Суарес-Варела М. (декабрь 2014 г.). «Доказательства безглютеновой и без казеиновой диеты при расстройствах аутистического спектра: систематический обзор». J Child Neurol. 29 (12): 1718–27. Дои:10.1177/0883073814531330. HDL:10171/37087. PMID 24789114. S2CID 19874518.
- ^ Миллуорд С., Ферритер М., Калвер С., Коннелл-Джонс Г. (2008). Ферритер М (ред.). «Диеты без глютена и казеина при расстройстве аутистического спектра». Кокрановская база данных Syst Rev (2): CD003498. Дои:10.1002 / 14651858.CD003498.pub3. ЧВК 4164915. PMID 18425890.
- ^ Volta U, Caio G, De Giorgio R, Henriksen C, Skodje G, Lundin KE (июнь 2015 г.). «Чувствительность к глютену, не связанная с глютеном: незавершенная работа в спектре заболеваний, связанных с пшеницей». Лучшая практика Res Clin Gastroenterol. 29 (3): 477–91. Дои:10.1016 / j.bpg.2015.04.006. PMID 26060112.
Предполагается, что расстройства аутистического спектра (РАС) связаны с NCGS [47, 48]. Примечательно, что диета без глютена и казеина может иметь положительный эффект в улучшении гиперактивности и спутанности сознания у некоторых пациентов с РАС. Эта очень захватывающая связь между NCGS и ASD заслуживает дальнейшего изучения, прежде чем можно будет сделать твердые выводы.
- ^ Сан-Мауро I, Гарикано Э, Колладо Л., Сьюдад MJ (декабрь 2014 г.). "¿Es el клейковина el gran agentte etiopatogenico de enfermedad en el siglo XXI?" [Является ли глютен великим этиопатогенным возбудителем болезней в XXI веке?]. Нутр Хосп (на испанском). 30 (6): 1203–10. Дои:10.3305 / nh.2014.30.6.7866. PMID 25433099.
внешние ссылки
| Классификация | |
|---|---|
| Внешние ресурсы |