Лобно-височная деменция - Frontotemporal dementia
Было предложено, чтобы эта статья была слился с участием Болезнь Пика. (Обсудить) Предлагается с октября 2020 года. |
| Лобно-височная деменция | |
|---|---|
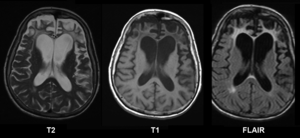 | |
| МРТ головного мозга женщины 65 лет с лобно-височной деменцией. Корковый и белое вещество атрофия фронтальные доли ясно на всех изображениях. | |
| Специальность | Психиатрия, неврология |
| Причины | лобно-височная долевая дегенерация |
Лобно-височная деменция (FTD), или лобно-височное нейрокогнитивное расстройство[1] охватывает несколько типов слабоумие с участием лобной и височные доли.[2] ЛВД широко представлены как поведенческие или языковые расстройства.[3] Три основных подтипа или вариантных синдромов представляют собой поведенческий вариант (bvFTD), ранее известный как Болезнь Пика,[4][5] и два варианта первичная прогрессирующая афазия –семантический вариант (svPPA) и неглубокий вариант (nfvPPA).[3][5] Два редких различных подтипа ЛТД: болезнь включения промежуточных филаментов нейронов (NIFID) и болезнь базофильных телец включения. Другие связанные расстройства включают: кортикобазальный синдром и FTD с боковой амиотрофический склероз (ALS) FTD-ALS также называется FTD-БДН.[6]
Лобно-височная деменция - это синдромы с ранним началом, которые связаны с лобно-височная долевая дегенерация (FTLD),[7] который характеризуется прогрессивным нейронный убыток, преимущественно связанный с лобной или височные доли, и типичная потеря более 70% нейроны веретена, в то время как другие типы нейронов остаются нетронутыми.[8]
Впервые FTD описал Арнольд Пик в 1892 году и первоначально назывался Болезнь Пика, термин теперь зарезервирован только для FTD, которые показывают наличие тел выбора и ячеек выбора.[9] [4][10] Второй только после Болезнь Альцгеймера (AD) в распространенность, FTD составляет 20% случаев слабоумия с ранним началом.[11] Признаки и симптомы обычно проявляются в позднем взрослом возрасте, чаще в возрасте от 45 до 65 лет, примерно одинаково затрагивая мужчин и женщин.[11]
Общие признаки и симптомы включают значительные изменения в социальном и личном поведении, апатию, притупление эмоций и дефицит как выразительной, так и восприимчивой речи. В настоящее время нет лекарства от ЛВД, но есть методы лечения, которые помогают облегчить симптомы.
Признаки и симптомы
Лобно-височная деменция (ЛВД) - это заболевание с ранним началом, которое возникает в возрасте до 65 лет, но может быть раньше или позже.[7] Сообщается, что постепенное начало и прогрессирование изменений в поведении или языковой недостаточности началось за несколько лет до обращения к неврологу.[6]
ЛВД традиционно трудно диагностировать из-за разнообразного характера сопутствующих симптомов. Признаки и симптомы делятся на три группы в зависимости от пораженных функций лобной и височные доли:[10] Это поведенческий вариант лобно-височной деменции, семантическая деменция и прогрессирующая нелокая афазия.
Поведенческий вариант лобно-височной деменции
Поведенческий вариант лобно-височной деменции (BvFTD) ранее был известен как Болезнь Пика, и является наиболее распространенным из типов FTD.[4] BvFTD диагностируется в четыре раза чаще, чем варианты PPA.[12] BvFTD характеризуется изменениями в социальном поведении и поведении с потерей социальной осведомленности и плохим контролем над импульсами.[13]
Семантическая деменция
Семантическая деменция (SD) характеризуется потерей семантический понимание, что приводит к нарушению понимания слов. Однако речь остается плавной и грамматической.[13]
Прогрессирующая нелегкая афазия
Прогрессирующая нелегкая афазия (PNFA) характеризуется прогрессирующими трудностями в производстве речи.[13]
Другие характеристики
У человека с ЛТД сохраняются следующие способности:[11]
- Восприятие
- Пространственные навыки
- объем памяти
- Праксис (двигательное планирование для выполнения задач или движений)
На более поздних стадиях ЛТД клинические фенотипы могут частично совпадать.[13] Пациенты с ЛТД обычно борются с переедание и компульсивное поведение.[14] Привычки переедания часто связаны с изменением пищевых предпочтений (тяга к большему количеству сладкого, углеводов), поеданием несъедобных предметов и отрыванием пищи у других. Недавние результаты структурных МРТ-исследований показали, что изменения в питании при ЛВД связаны с атрофией (истощением) в правой брюшной полости. островок, полосатое тело, и орбитофронтальная кора.[14]
У людей с ЛТД наблюдаются выраженные недостатки исполнительной функции и рабочей памяти.[15] Большинство из них теряют способность выполнять навыки, требующие сложного планирования или последовательности.[16] Помимо характерной когнитивной дисфункции, ряд примитивные рефлексы известный как знаки фронтального выпуска часто можно выявить. Обычно первым из этих фронтальных признаков выпуска является ладонный рефлекс который появляется относительно рано в течение болезни, тогда как ладонная хватка рефлекс и укорененный рефлекс появляются на поздних стадиях течения болезни.
В редких случаях ЛВД может возникать у людей с боковой амиотрофический склероз (ALS) а заболевание двигательного нейрона. Прогноз для людей с БАС хуже в сочетании с ЛТД, сокращая выживаемость примерно на год.[17]
Генетика
Похоже, что более высокая доля случаев ЛВД имеет семейный компонент, чем более распространенные нейродегенеративные заболевания, такие как Болезнь Альцгеймера. Все больше и больше мутаций и генетических вариантов выявляется постоянно, поэтому списки генетических влияний требуют постоянного обновления.
- Тау-положительный лобно-височная деменция и паркинсонизм, связанные с хромосомой 17 (FTDP-17) вызывается мутациями в MAPT ген на хромосоме 17, который кодирует тау-белок.[18] Было установлено, что существует прямая взаимосвязь между типом мутации тау и невропатологией мутаций генов. Мутации в месте сплайсинга экзона 10 тау-белка приводят к избирательному отложению повторяющегося тау-белка в нейронах и глии. Патологический фенотип, связанный с мутациями в другом месте тау-белка, менее предсказуем как с типичными нейрофибриллярными клубками (состоящими из 3-х и 4-х повторов тау-белка), так и с тельцами Пика (состоящими из 3-х повторов тау-белка), имеющими был описан. Присутствие отложений тау внутри глии также варьирует в семьях с мутациями вне экзона 10. Это заболевание теперь неофициально обозначается FTDP-17T. FTD показывает связь с областью локуса tau на хромосоме 17, но считается, что есть два локуса, ведущих к FTD, в пределах мегабаз друг от друга на хромосоме 17.[19]
- FTD, вызванная FTLD-TDP43, имеет множество генетических причин. Некоторые случаи связаны с мутациями в GRN ген, также расположенный на хромосоме 17. Другие вызываются VCP мутации, хотя у этих пациентов наблюдается сложная картина мультисистемная протеинопатия что может включать боковой амиотрофический склероз, миопатия с тельцами включения, Костная болезнь Педжета, и FTD. Самым последним добавлением в список является экспансия гексануклеотидного повтора в интроне 1 C9ORF72.[20] Сообщалось только об одном или двух случаях, описывающих TARDBP (в ТДП-43 гена) мутации в клинически чистой FTD (FTD без БДН ).
- С этим состоянием связаны несколько других генов. Они включают CYLD, OPTN, SQSTM1 и TBK1.[21] Эти гены участвуют в пути аутофагии.
- Нет генетических причин FUS патологии при ЛТД пока не поступало.
Патология
При вскрытии обнаруживаются три основных гистологических подтипа: FTLD-tau, FTLD-TDP и FTLD-FUS. Деменция без отличительной гистологии (DLDH) - редкое и противоречивое явление. Новый анализ позволил переклассифицировать многие случаи, ранее описанные как DLDH, в одну из положительно определенных подгрупп. В редких случаях у пациентов с клинической ЛТД обнаруживались изменения, соответствующие Болезнь Альцгеймера на вскрытие.[22] Наиболее тяжелая атрофия головного мозга связана с Болезнь Пика, кортикобазальная дегенерация и патология TDP, связанная с поведенческой ЛВД.[23]
Что касается обнаруженных генетических дефектов, повторить экспансию в C9orf72 ген считается основным вкладом в лобно-височная долевая дегенерация, хотя недоработки GRN и MAPT с ним также связаны гены.[24]
Диагностика
Структурная МРТ часто выявляет атрофию лобной доли и / или передней височной доли, но в ранних случаях сканирование может показаться нормальным. Атрофия может быть двусторонней или асимметричной.[11] Регистрация изображений в разные моменты времени (например, с разницей в один год) может показать свидетельство атрофии, которое в противном случае (в отдельные моменты времени) может рассматриваться как нормальное. Многие исследовательские группы начали использовать такие методы, как магнитно-резонансная спектроскопия, функциональная визуализация и измерение толщины коры, в попытке предложить более ранний диагноз пациенту с FTD. Позитронно-эмиссионная томография (ФДГ-ПЭТ) с фтор-18-фтордезоксиглюкозой, как правило, выявляет лобный и / или передний височный гипометаболизм, что помогает дифференцировать заболевание от болезни Альцгеймера. В ПЭТ сканирование при болезни Альцгеймера классически показывает бипариетальный гипометаболизм. Мета-анализ, основанный на методах визуализации, показал, что лобно-височная деменция в основном затрагивает лобно-медиальную сеть, обсуждаемую в контексте социального познания илитеория разума '.[25] Это полностью согласуется с представлением о том, что на основе когнитивных нейропсихологических данных вентромедиальная префронтальная кора головного мозга является основным локусом дисфункции на ранней стадии развития поведенческого варианта лобно-височной дегенерации.[26] Языковые подтипы лобно-височной долевой дегенерации (семантическая деменция и прогрессирующая нефлюентная афазия) могут быть регионально разделены с помощью методов визуализации. in vivo.[27]
Путаница между болезнью Альцгеймера и ЛТД вполне оправдана из-за сходства их начальных симптомов. У пациентов нет проблем с движением и другими двигательными задачами.[28] По мере появления симптомов ЛТД трудно отличить диагноз болезни Альцгеймера от ЛТД. Существуют явные различия в поведенческих и эмоциональных симптомах этих двух деменций, в частности, в притуплении эмоций, наблюдаемом у пациентов с ЛТД.[11] На ранних стадиях ЛВД часто встречаются тревога и депрессия, что может привести к неоднозначному диагнозу. Однако со временем эти неоднозначности исчезают по мере прогрессирования деменции и начинают появляться определяющие симптомы апатии, характерные только для ЛВД.
Недавние исследования, проводившиеся в течение нескольких лет, разработали новые критерии диагностики поведенческого варианта лобно-височной деменции (bvFTD). Шесть различных клинических признаков были идентифицированы как симптомы bvFTD.[29]
- Растормаживание
- Апатия / Инерция
- Утрата Сочувствие /Сочувствие
- Персеверативный /компульсивное поведение
- Гипероральность
- Дизэксплуатационный нейропсихологический профиль
Из шести признаков три должны присутствовать у пациента, чтобы диагностировать одну с возможным bvFTD. Как и при стандартной ЛТД, первичный диагноз ставится на основании клинических испытаний, в ходе которых выявляются сопутствующие симптомы, а не исследований с использованием изображений.[29] Вышеупомянутые критерии используются для отличия bvFTD от таких заболеваний, как болезнь Альцгеймера и других причин деменции. Кроме того, новые критерии позволяют разделить диагностическую иерархию на возможные, вероятные и определенные bvFTD на основе количества присутствующих симптомов.
Нейропсихологические тесты
Прогрессирование дегенерации, вызванной bvFTD, может иметь предсказуемый характер. Дегенерация начинается в орбитофронтальной коре и медиальных отделах, таких как вентромедиальная кора. На более поздних стадиях он постепенно расширяется до дорсолатеральной коры и височной доли.[30] Таким образом, обнаружение дисфункции орбитофронтальной коры и вентромедиальной коры важно для выявления ранней стадии bvFTD. Как указывалось выше, изменение поведения может произойти до появления какой-либо атрофии в головном мозге в ходе заболевания. Из-за этого сканирование изображений, такое как МРТ, может быть нечувствительным к ранней дегенерации, и трудно обнаружить раннюю стадию bvFTD.
В нейропсихологии растет интерес к использованию нейропсихологических тестов, таких как Задание на азартные игры в Айове или Тест распознавания Faux Pas в качестве альтернативы визуализации для диагностики bvFTD.[31] Как известно, азартные игры штата Айова и тест Faux Pas чувствительны к дисфункции орбитофронтальной коры.
Тест на распознавание ложных пропусков предназначен для измерения способности обнаруживать социальные ошибки типа ложных ошибок (случайно сделать заявление или действие, оскорбляющее других). Предполагается, что люди с дисфункцией орбитофронтальной коры имеют тенденцию совершать социальные ошибки из-за дефицита самоконтроля.[32] Самоконтроль - это способность людей оценивать свое поведение, чтобы убедиться, что их поведение соответствует конкретным ситуациям. Нарушение самоконтроля приводит к недостатку сигналов социальных эмоций. Социальные эмоции, такие как смущение, важны тем, что они сигнализируют человеку о необходимости адаптировать социальное поведение надлежащим образом для поддержания отношений с другими. Хотя пациенты с повреждением OFC сохраняют неизменные знания социальных норм, они не могут применить их к реальному поведению, потому что они не могут генерировать социальные эмоции, которые способствуют адаптивному социальному поведению.[32]
Другой тест, задание на азартные игры в Айове, представляет собой психологический тест, предназначенный для моделирования принятия решений в реальной жизни. В основе этого теста лежит гипотеза соматического маркера. Эта гипотеза утверждает, что, когда людям приходится принимать сложные неопределенные решения, они используют как когнитивные, так и эмоциональные процессы, чтобы оценить ценность выбора, доступного им. Каждый раз, когда человек принимает решение, и физиологические сигналы, и вызванные эмоции (соматический маркер) связаны с их результатами и накапливаются в виде опыта. Люди склонны выбирать тот выбор, который может привести к результату, подкрепленному положительными стимулами, таким образом, он смещает принятие решений в сторону определенных форм поведения, избегая других.[33] Считается, что соматический маркер обрабатывается в орбитофронтальной коре.
Симптомы, наблюдаемые при bvFTD, вызваны дисфункцией орбитофронтальной коры, поэтому эти два нейропсихологических теста могут быть полезны для выявления ранней стадии bvFTD. Однако, поскольку процессы самоконтроля и соматических маркеров настолько сложны, они, вероятно, затрагивают другие области мозга. Таким образом, нейропсихологические тесты чувствительны к дисфункции орбитофронтальной коры, но не специфичны для нее. Слабость этих тестов заключается в том, что они не обязательно показывают дисфункцию орбитофронтальной коры.
Чтобы решить эту проблему, некоторые исследователи объединили нейропсихологические тесты, выявляющие дисфункцию орбитофронтальной коры, в один, чтобы повысить его специфичность к дегенерации лобной доли, чтобы выявить раннюю стадию bvFTD. Они изобрели Батарея исполнительного и социального познания который включает пять нейропсихологических тестов.[31]
- Задание на азартные игры в Айове
- Тест Faux Pas
- Задача отеля
- Разум в глазах
- Несколько поручений
Результат показал, что этот комбинированный тест более чувствителен при обнаружении дефицита при раннем bvFTD.[31]
Управление
В настоящее время лекарства от FTD не существует. Существуют методы лечения поведенческих симптомов. Растормаживание и компульсивное поведение можно контролировать с помощью селективные ингибиторы обратного захвата серотонина (СИОЗС).[34][35] Хотя болезнь Альцгеймера и ЛТД имеют общие симптомы, их нельзя лечить одними и теми же фармакологическими средствами, поскольку холинергический системы не затронуты в FTD.[11]
Поскольку ЛВД часто встречается у молодых людей (например, в возрасте от 40 до 50 лет), это может серьезно повлиять на семью. Часто у пациентов все еще есть дети, живущие дома. В финансовом отношении это может иметь разрушительные последствия, поскольку болезнь поражает в тот период жизни, который часто включает годы с максимальной заработной платой.
Прогноз
Симптомы лобно-височной деменции прогрессируют быстро и стабильно. Пациенты, страдающие этим заболеванием, могут прожить 2–20 лет. В конце концов, пациенты будут нуждаться в круглосуточном уходе для повседневной работы.[36]
Утечки CSF являются известной причиной обратимой лобно-височной деменции.[37]
История
Лобно-височная деменция была впервые описана Пиком в 1892 году.[38] В 1989 году Сноуден предложил термин «семантическая деменция» для описания пациента с преобладающей левой височной атрофией и афазией, описанными Пиком. Первые критерии исследования ЛВД «Клинические и невропатологические критерии лобно-височной деменции. Группы Лунда и Манчестера »была разработана в 1994 году. Клинические диагностические критерии были пересмотрены в конце 1990-х годов, когда спектр ЛВД был разделен на поведенческий вариант, вариант нелегкой афазии и семантический вариант деменции.[12] Самый последний пересмотр критериев клинических исследований был проведен Международным консорциумом критериев поведенческих вариантов FTD (FTDC) в 2011 году.[39]
Смотрите также
использованная литература
- ^ Диагностическое и статистическое руководство психических расстройств: DSM-5 (5-е изд.). Арлингтон, Вирджиния: Американская психиатрическая ассоциация. 2013. С. 614–618. ISBN 9780890425541.
- ^ «МКБ-11 - Статистика смертности и заболеваемости». icd.who.int.
- ^ а б Sivasathiaseelan, H; Маршалл, CR; Agustus, JL; и другие. (Апрель 2019 г.). «Лобно-височная деменция: клинический обзор». Семинары по неврологии. 39 (2): 251–263. Дои:10.1055 / с-0039-1683379. PMID 30925617.
- ^ а б c «Каковы различные типы лобно-височных заболеваний?». Национальный институт старения. Получено 1 ноября 2020.
- ^ а б «Что такое лобно-височная деменция». Деменция Великобритания. Получено 19 октября 2020.
- ^ а б Finger, EC (апрель 2016 г.). «Лобно-височное слабоумие». Continuum (Миннеаполис, Миннесота). 22 (2 Деменция): 464–89. Дои:10.1212 / CON.0000000000000300. ЧВК 5390934. PMID 27042904.
- ^ а б Хофманн Дж. У., Сили У. В., Хуанг Э. Дж., Кубота М. (24 января 2019 г.). «РНК-связывающие белки и патогенез дегенерации лобно-височной долей». Ежегодный обзор патологии. 14: 469–495. Дои:10.1146 / annurev-pathmechdis-012418-012955. ЧВК 6731550. PMID 30355151.
- ^ «Клетки мозга для общения». Смитсоновский институт. Получено 30 октября 2015.
- ^ Принципы неврологии Адамса и Виктора (одиннадцатое изд.). МакГроу Хилл. 2019. стр. 1096.
- ^ а б Кардарелли Р., Кертес А., Кнебль Дж. А. (декабрь 2010 г.). «Лобно-височная деменция: обзор для врачей первичного звена». Am Fam Врач. 82 (11): 1372–7. PMID 21121521.
- ^ а б c d е ж Сноуден Дж. С., Нири Д., Манн Д. М. (февраль 2002 г.). «Лобно-височная деменция». Br J Психиатрия. 180 (2): 140–3. Дои:10.1192 / bjp.180.2.140. PMID 11823324.
- ^ а б Олни, Николас Т .; Спина, Сальваторе; Миллер, Брюс Л. (май 2017 г.). «Лобно-височная деменция». Неврологические клиники. 35 (2): 339–374. Дои:10.1016 / j.ncl.2017.01.008. ISSN 0733-8619. ЧВК 5472209. PMID 28410663.
- ^ а б c d Слейгерс К., Крутс М., Ван Брокховен С. (2010). «Молекулярные пути лобно-височной долевой дегенерации». Ежегодный обзор нейробиологии. 33 (1): 71–88. Дои:10.1146 / annurev-neuro-060909-153144. PMID 20415586.
- ^ а б Piguet O (ноябрь 2011 г.). «Нарушение питания при лобно-височной деменции с поведенческим вариантом». J. Mol. Неврологи. 45 (3): 589–93. Дои:10.1007 / s12031-011-9547-х. PMID 21584651. S2CID 24125998.
- ^ Нири Д., Сноуден Дж, Манн Д. (2005). «Лобно-височная деменция». Ланцет Нейрол. 4 (11): 771–80. Дои:10.1016 / с1474-4422 (05) 70223-4. PMID 16239184. S2CID 17310802.
- ^ Крамер Дж. Х., Юрик Дж., Ша С. Дж. И др. (Декабрь 2003 г.). «Отличительные нейропсихологические модели лобно-височной деменции, семантической деменции и болезни Альцгеймера». Cogn Behav Neurol. 16 (4): 211–8. Дои:10.1097/00146965-200312000-00002. PMID 14665820. S2CID 46800951.
- ^ Олни Р.К., Мерфи Дж., Форшью Д. и др. (Декабрь 2005 г.). «Влияние исполнительной и поведенческой дисфункции на течение БАС». Неврология. 65 (11): 1774–7. Дои:10.1212 / 01.wnl.0000188759.87240.8b. PMID 16344521. S2CID 11672234.
- ^ Люк Буэ; Андре Делакурт (1999). «Сравнительная биохимия тау-белка при прогрессирующем надъядерном параличе, кортикобазальной дегенерации, FTDP-17 и болезни Пика». Патология головного мозга. 9 (4): 681–693. Дои:10.1111 / j.1750-3639.1999.tb00550.x. PMID 10517507. S2CID 10711305.
- ^ Харди, Джон; Момени, Парастоо; Трейнор, Брайан Дж. (Апрель 2006 г.). «Фронтальная височная деменция: анализ этиологии и патогенеза» (PDF). Мозг. 26. 129 (4): 830–831. Дои:10.1093 / мозг / awl035. PMID 16543401. Получено 8 июля, 2017.
- ^ Convery R, Mead S, Rohrer JD (2018) Клинические, генетические и нейровизуализационные особенности лобно-височной деменции. Neuropathol Appl Neurobiol
- ^ Добсон-Стоун К., Халлупп М., Шахейдари Х., Рагагнин AMG, Чаттертон З., Кэрью-Джонс Ф., Шеперд С.Э., Стефен Х., Парик Е, Фат Т, Томпсон Э.М., Блумбергс П., Короткий CL, Полевой компакт-диск, Панегирес П.К., Хеккер Дж., Николсон Дж., Шоу А. Д., Фуллертон Дж. М., Льюти А. А., Шофилд П. Р., Брукс В. С., Раджан Н., Беннетт М. Ф., Бахло М., Ландерс Дж. Э., Пигет О., Ходжес Дж. Р., Холлидей Дж. М., Топп С. Д., Смит Б. Н., Шоу К. Э., Макканн Е., Фифита Дж. А., Уильямс К. Л., Аткин Дж. Д., Блэр И. П., Квок Дж. Б. (2020). «CYLD - ген, вызывающий лобно-височную деменцию - боковой амиотрофический склероз». Мозг. 143 (3): 783–799. Дои:10.1093 / мозг / awaa039. ЧВК 7089666. PMID 32185393.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Лискич Р.М., Сторандт М., Кэрнс, штат Нью-Джерси, Моррис, Дж.С. (апрель 2007 г.). «Клинические и психометрические различия лобно-височной деменции и болезни Альцгеймера». Arch. Neurol. 64 (4): 535–40. Дои:10.1001 / archneur.64.4.535. PMID 17420315.
- ^ Джонатан Д. Рорер; Таммарин Лэшли; Джонатан М. Шотт; Джейн Э. Уоррен; Саймон Мид; Адриан М. Айзекс; Джонатан Бек; Джон Харди; Рохан де Сильва; Элизабет Уоррингтон; Клэр Троакс; Сафа ас-Саррадж; Эндрю Кинг; Барбара Боррони; Мэтью Дж. Кларксон; Себастьен Урселин; Дженис Л. Холтон; Ник С. Фокс; Тамас Ревес; Мартин Н. Россор и Джейсон Д. Уоррен (автор-корреспондент) (сентябрь 2011 г.). «Клинические и нейроанатомические признаки патологии тканей при лобно-височной долевой дегенерации». Мозг. 134 (9): 2565–2581. Дои:10.1093 / мозг / awr198. ЧВК 3170537. PMID 21908872.
- ^ ван дер Зи, Джули; Ван Брокховен, Кристина (7 января 2014 г.). «Деменция в 2013 году: лобно-височная долевая дегенерация - на основе достижений». Обзоры природы Неврология. 10 (2): 70–72. Дои:10.1038 / nrneurol.2013.270. PMID 24394289.
- ^ Schroeter ML, Raczka KK, Neumann J, von Cramon DY (2008). «Нейронные сети при лобно-височной деменции - метаанализ». Нейробиология старения. 29 (3): 418–426. Дои:10.1016 / j.neurobiolaging.2006.10.023. PMID 17140704. S2CID 9039002.
- ^ Рахман С., Саакян Б.Дж., Ходжес-младший, Роджерс Р.Д., Роббинс Т.В. (август 1999 г.). «Специфические когнитивные нарушения при лёгком лобном варианте лобно-височной деменции» (PDF). Мозг. 122 (Pt 8): 1469–93. Дои:10.1093 / мозг / 122.8.1469. PMID 10430832.
- ^ Schroeter ML, Raczka KK, Neumann J, von Cramon DY (2007). «К нозологии лобно-височной долевой дегенерации - метаанализ с участием 267 субъектов». NeuroImage. 36 (3): 497–510. Дои:10.1016 / j.neuroimage.2007.03.024. PMID 17478101. S2CID 130161.
- ^ Стейнбарт EJ, Смит CO, Poorkaj P, Bird TD (ноябрь 2001 г.). «Влияние тестирования ДНК на семейную болезнь Альцгеймера с ранним началом и лобно-височную деменцию». Arch. Neurol. 58 (11): 1828–31. Дои:10.1001 / archneur.58.11.1828. PMID 11708991.
- ^ а б Rascovsky K, Hodges JR, Knopman D, et al. (Сентябрь 2011 г.). «Чувствительность пересмотренных диагностических критериев для поведенческого варианта лобно-височной деменции» (PDF). Мозг. 134 (Pt 9): 2456–77. Дои:10.1093 / мозг / awr179. ЧВК 3170532. PMID 21810890.
- ^ Krueger, C.E .; Bird, A.C .; Growdon, M.E .; Jang, J.Y .; Миллер, Б. И Крамер, Дж. (2009). «Конфликт в мониторинге ранней лобно-височной деменции». Неврология. 73 (5): 349–55. Дои:10.1212 / wnl.0b013e3181b04b24. ЧВК 2725928. PMID 19652138.
- ^ а б c Торральва, Т; Рока, М; Gleichgerrcht, E; Бекинштайн, T & Manes, F (2009). «Нейропсихологическая батарея для выявления конкретных исполнительных и социальных когнитивных нарушений при ранней лобно-височной деменции» (PDF). Мозг. 132 (5): 1299–1309. Дои:10.1093 / мозг / awp041. PMID 19336463.
- ^ а б Beer, J.S .; John, O.P .; Скабини Д. и Найт Р. (2006). «Орбитофронтальная кора и социальное поведение: интеграция самоконтроля и взаимодействия эмоций и познания». Журнал когнитивной неврологии. 18 (6): 871–888. CiteSeerX 10.1.1.527.3607. Дои:10.1162 / jocn.2006.18.6.871. PMID 16839295. S2CID 13590871.
- ^ Damasio, A.R .; Everitt, B.J .; Бишоп, Д. (29 октября 1996 г.). «Гипотеза соматических маркеров и возможные функции префронтальной коры». Фил. Пер. R. Soc. Лондон. B. 351 (1346): 1413–20. Дои:10.1098 / rstb.1996.0125. PMID 8941953. S2CID 1841280.
- ^ Swartz JR, Miller BL, Lesser IM, Darby AL (май 1997). «Лобно-височная деменция: лечебный ответ на селективные ингибиторы обратного захвата серотонина». J Clin Психиатрия. 58 (5): 212–6. Дои:10.4088 / jcp.v58n0506. PMID 9184615.
- ^ «Лекарства от поведенческих симптомов». ucsf.edu. Получено 30 октября 2015.
- ^ Кертес А. (июнь 2004 г.). «Лобно-височная деменция / болезнь Пика». Arch. Neurol. 61 (6): 969–71. Дои:10.1001 / archneur.61.6.969. PMID 15210543.
- ^ Самсон, К. (2002). «Гипотония может вызвать лобно-височную деменцию». Неврология сегодня. 2 (9): 35–36. Дои:10.1097/00132985-200209000-00013.
- ^ ПИК, А. (1892). "Uber die Beziehungen der senilen Hirnatrophie zur Aphasie". Prag Med Wochenschr. 17: 165–167.
- ^ Расковский, Катя; Ходжес, Джон Р .; Кнопман, Дэвид; Мендес, Марио Ф .; Kramer, Joel H .; Нейгауз, Джон; ван Свитен, Джон С .; Силаар, Харро; Доппер, Элиза Г. П .; Onyike, Chiadi U .; Хиллис, Аргье Э. (сентябрь 2011 г.). «Чувствительность пересмотренных диагностических критериев для поведенческого варианта лобно-височной деменции». Мозг. 134 (9): 2456–2477. Дои:10.1093 / мозг / awr179. ISSN 0006-8950. ЧВК 3170532. PMID 21810890.
дальнейшее чтение
- Лю, Вт; Miller, B.L .; Kramer, J. H .; Ранкин, К .; Wyss-Coray, C .; Gearhart, R .; Phengrasamy, L .; Weiner, M .; Розен, Х. Дж. (1 марта 2004 г.). «Расстройства поведения при лобно-височном вариантах лобно-височной деменции». Неврология. 5. 62 (5): 742–748. Дои:10.1212 / 01.WNL.0000113729.77161.C9. ЧВК 2367136. PMID 15007124.
- Ходжес, Дж. Р. (2 апреля 2003 г.). «Исследование стереотипного поведения при болезни Альцгеймера и лобно-височной разновидности лобно-височной деменции». Neurol Neurosurg Psychiatry. 74 (10): 1398–1402. Дои:10.1136 / jnnp.74.10.1398. ЧВК 1757381. PMID 14570833.
- Пагон Р.А. и др. (1993). «GRN-связанная лобно-височная деменция». GeneReviews. PMID 20301545.
- Пагон Р.А. и др. (1993). «Заболевания, связанные с MAPT, включая лобно-височную деменцию с паркинсонизмом-17 (FTDP-17)». GeneReviews. PMID 20301678.
- Мэрилин Рейнольдс. "'Мемуары "Пока смерть или слабоумие не разлучит нас". Речные рок-книги.
- Апсон, Сандра (15 апреля 2020 г.). "Разрушительный упадок блестящего молодого кодера". Проводной. Получено 17 сентября 2020.
внешние ссылки
| Классификация | |
|---|---|
| Внешние ресурсы |
