Болезнь Альцгеймера - Alzheimers disease - Wikipedia
| Болезнь Альцгеймера | |
|---|---|
| Другие имена | Болезнь Альцгеймера, болезнь Альцгеймера |
 | |
| Сравнение мозга нормального пожилого человека (слева) и мозга человека с болезнью Альцгеймера (справа). Указаны характеристики, разделяющие их. | |
| Произношение |
|
| Специальность | Неврология |
| Симптомы | Трудности с запоминанием недавних событий, проблемы с языком, дезориентация, перепады настроения[1][2] |
| Обычное начало | Старше 65 лет[3] |
| Продолжительность | Долгосрочный[2] |
| Причины | Плохо понял[1] |
| Факторы риска | Генетика, травмы головы, депрессия, гипертония[1][4] |
| Диагностический метод | На основании симптомов и когнитивное тестирование после исключения других возможных причин[5] |
| Дифференциальная диагностика | Нормальное старение[1] |
| Медикамент | Ингибиторы ацетилхолинэстеразы, Антагонисты рецепторов NMDA (небольшое преимущество)[6] |
| Прогноз | Ожидаемая продолжительность жизни 3–9 лет[7] |
| Частота | 29,8 миллиона (2015)[2][8] |
| Летальные исходы | 1,9 миллиона (2015)[9] |
Болезнь Альцгеймера (ОБЪЯВЛЕНИЕ), также обозначаемый просто как Болезнь Альцгеймера, является хроническим нейродегенеративное заболевание это обычно начинается медленно и со временем постепенно ухудшается.[1][2] Это причина 60–70% случаев слабоумие.[1][2] Наиболее частый ранний симптом: трудности с запоминанием недавних событий.[1] По мере развития болезни симптомы могут включать: проблемы с языком, дезориентация (в том числе легко заблудиться), перепады настроения, утрата мотивация, не управляющий самообслуживание, и поведенческие проблемы.[1][2] По мере того как состояние человека ухудшается, он часто отдаляется от семьи и общества.[1] Постепенно функции организма теряются, что в конечном итоге приводит к смерти.[10] Хотя скорость прогрессирования может варьироваться, типичная продолжительность жизни после постановки диагноза составляет от трех до девяти лет.[7][11]
Причина болезни Альцгеймера плохо изучена.[1] Считается, что около 70% риска унаследованный от родителей человека, со многими гены обычно участвует.[4] К другим факторам риска относятся: травмы головы, депрессия, и гипертония.[1] Болезненный процесс связан с бляшки и нейрофибриллярные сплетения в мозг.[4] Вероятный диагноз основывается на истории болезни и когнитивное тестирование с медицинская визуализация и анализы крови чтобы исключить другие возможные причины.[5] Начальные симптомы часто принимают за нормальное старение.[1] Для постановки точного диагноза необходимо исследование ткани головного мозга.[4] Ментальный и физическое упражнение, и избегая ожирение может снизить риск AD; однако доказательств в поддержку этих рекомендаций недостаточно.[4][12] Нет лекарств или добавок, которые снижают риск.[13]
Никакие методы лечения не останавливают или не обращают вспять его прогрессирование, хотя некоторые могут временно улучшить симптомы.[2] Пострадавшие люди все чаще полагаются на помощь других, что часто ложится бременем на опекун.[14] Давление может включать социальные, психологические, физические и экономические элементы.[14] Программы упражнений могут быть полезны в отношении ежедневные занятия и потенциально может улучшить результаты.[15] Поведенческие проблемы или психоз из-за деменции часто лечат нейролептики, но обычно это не рекомендуется, поскольку от этого мало пользы и повышается риск ранней смерти.[16][17]
По состоянию на 2015 год во всем мире насчитывалось около 29,8 миллиона человек с БА.[8] с примерно 50 миллионами по состоянию на 2020 год.[2] Чаще всего начинается у людей старше 65 лет, хотя в 4–5% случаев болезнь Альцгеймера с ранним началом.[3] Им страдают около 6% людей 65 лет и старше.[1] В 2015 году деменция стала причиной смерти около 1,9 миллиона человек.[9] Заболевание названо в честь немецкого психиатра и патологоанатома. Алоис Альцгеймер, который впервые описал его в 1906 году.[18] В развитые страны, AD - одно из самых дорогостоящих заболеваний.[19][20]
Признаки и симптомы
- Влияние старения на память но не AD
- Забывая вещи иногда
- Иногда неправильно кладут предметы
- Незначительный краткосрочная память потеря
- Не помня точных деталей
- Ранняя стадия болезни Альцгеймера
- Незнание эпизодов забывчивости
- Забывает имена семьи или друзей
- Изменения могут заметить только близкие друзья или родственники
- Некоторая путаница в ситуациях за пределами привычного
- Средняя стадия болезни Альцгеймера
- Сложнее запоминать недавно полученную информацию
- Углубление замешательства во многих обстоятельствах
- Проблемы со сном
- Проблемы с определением их местоположения
- Поздняя стадия болезни Альцгеймера
- Плохая способность думать
- Проблемы с разговором
- Повторяет одни и те же разговоры
- Более агрессивный, тревожный или параноидальный
Течение болезни делится на четыре стадии, с прогрессирующим характером познавательный и функциональный обесценение.

Преддеменция
Первые симптомы часто ошибочно относят к старение или же стресс.[22] Подробно нейропсихологическое тестирование может выявить умеренные когнитивные проблемы в течение восьми лет до того, как человек будет соответствовать клиническим критериям диагноз нашей эры.[23] Эти ранние симптомы могут повлиять на самые сложные ежедневные занятия.[24] Самый заметный дефицит - это краткосрочная память потеря, которая проявляется в затруднении запоминания недавно изученных фактов и неспособности получить новую информацию.[23][25]
Тонкие проблемы с исполнительные функции из внимательность, планирование, гибкость и абстрактное мышление, или обесценения в семантическая память (запоминание значений и взаимосвязей понятий) также может быть симптомом ранних стадий БА.[23] Апатия На этой стадии можно увидеть депрессию, при этом апатия остается наиболее стойким симптомом на протяжении всего течения болезни.[26][27]Доклиническая стадия заболевания также получила название легкие когнитивные нарушения (MCI).[25] Часто оказывается, что это переходный этап между нормальным старением и слабоумие. MCI может проявляться множеством симптомов, и когда потеря памяти является преобладающим симптомом, это называется «амнестическим MCI» и часто рассматривается как продромальный стадия болезни Альцгеймера.[28]
Рано
У людей с БА увеличивающееся нарушение обучаемости и памяти в конечном итоге приводит к окончательному диагнозу. У небольшого процента проблемы с речью, исполнительными функциями, восприятие (агнозия ), либо выполнение движений (апраксия ) более заметны, чем проблемы с памятью.[29] AD не влияет одинаково на все объемы памяти. Старые воспоминания жизни человека (эпизодическая память ), изученные факты (семантическая память ), и неявная память (память тела о том, как что-то делать, например, использовать вилку, чтобы есть или как пить из стакана) затрагиваются в меньшей степени, чем новые факты или воспоминания.[30][31]
Языковые проблемы в основном характеризуются усадкой словарный запас и уменьшенное слово Беглость, что приводит к общему обеднению орального и письменный язык.[29][32] На этой стадии человек с болезнью Альцгеймера обычно способен адекватно передавать основные идеи.[29][32][33] Во время выполнения мелкая моторика такие как письмо, рисование или одевание, могут присутствовать определенные трудности координации движений и планирования (апраксия), но они обычно остаются незамеченными.[29] По мере прогрессирования болезни люди с БА часто могут продолжать выполнять многие задачи самостоятельно, но при выполнении наиболее сложных задач могут потребоваться помощь или наблюдение.[29]
Умеренный
Прогрессивное ухудшение в конечном итоге препятствует независимости, поскольку субъекты не могут выполнять самые обычные повседневные дела.[29] Проблемы с речью становятся очевидными из-за неспособности вспомнить словарный запас, что приводит к частым неправильным заменам слов (парафазии ). Также постепенно теряются навыки чтения и письма.[29][33] Сложные двигательные последовательности становятся менее скоординированными с течением времени и прогрессированием БА, поэтому риск падения увеличивается.[29] На этом этапе ухудшаются проблемы с памятью, и человек может не узнавать близких родственников.[29] Долгосрочная память, который ранее не был поврежден, становится поврежденным.[29]
Поведенческие и психоневрологический изменения становятся более распространенными. Общие проявления: блуждающий, раздражительность и лабильный аффект, приводящие к плачу, вспышкам непреднамеренных агрессия, или сопротивление заботе.[29] Закат также может появиться.[34] Примерно у 30% людей с БА развивается иллюзорные ошибочные определения и другие бредовый симптомы.[29] Субъекты также теряют понимание процесса своего заболевания и ограничений (анозогнозия ).[29] Недержание мочи может развиваться.[29] Эти симптомы создают стресс для родственников и опекунов, которые могут быть сокращены путем перемещения человека из домашний уход другим учреждения длительного ухода.[29][35]
Передовой
На заключительных этапах пациент полностью зависит от опекунов.[29] Язык сводится к простым фразам или даже отдельным словам, что в конечном итоге приводит к полной потере речи.[29][33] Несмотря на потерю речевых способностей, люди часто могут понимать и возвращать эмоциональные сигналы. Хотя агрессивность все еще может присутствовать, крайняя апатия и истощение гораздо чаще встречаются симптомы. Люди с болезнью Альцгеймера в конечном итоге не смогут самостоятельно выполнять даже самые простые задачи; мышечная масса и подвижность ухудшается до такой степени, что они прикованы к постели и не могут прокормить себя. Причиной смерти обычно является внешний фактор, например, заражение пролежни или же пневмония, а не сама болезнь.[29]
Причины
Считается, что болезнь Альцгеймера возникает при аномальном количестве белков, амилоиды и возможно тау-белки, образуются в головном мозге и начинают вторгаться в клетки органа. Результирующий бляшка нарушает нормальное функционирование и химию и приводит к значительному дефициту нейротрансмиттеры, что приводит к прогрессирующей потере функции мозга.[36] Что касается Почему эти белковые «сбои» происходят в первую очередь, их конечная причина плохо изучена и является предметом постоянных исследований и предположений.
Причина большинства случаев болезни Альцгеймера по-прежнему в основном неизвестна, за исключением 1–5% случаев, когда были выявлены генетические различия.[37][38] Несколько конкурирующих гипотезы существуют попытки объяснить причину болезни.
Генетический
Генетическая наследственность болезни Альцгеймера (и ее компонентов памяти), основанная на обзорах исследований близнецов и семей, колеблется от 49% до 79%.[39] Около 0,1% случаев составляют семейные формы аутосомный (нет связанный с полом ) доминирующий наследование, которое наступило до 65 лет.[40] Эта форма болезни известна как семейная болезнь Альцгеймера с ранним началом. Большинство случаев аутосомно-доминантной семейной БА можно объяснить мутациями в одном из трех генов: генах, кодирующих белок-предшественник амилоида (APP) и пресенилины PSEN1 и PSEN2.[41] Большинство мутаций в генах АРР и пресенилина увеличивают производство небольшого белка, называемого Aβ 42, который является основным компонентом старческие бляшки.[42] Некоторые мутации просто изменяют соотношение между Aβ42 и другими основными формами, особенно Aβ40, без повышения уровня Aβ42.[43] Два других гена, связанных с аутосомно-доминантной болезнью Альцгеймера: ABCA7 и SORL1.[44]
Большинство случаев болезни Альцгеймера не имеют аутосомно-доминантного наследования и называются спорадической БА, при которой экологические и генетические различия могут действовать как факторы риска. Самый известный генетический фактор риска - это наследование ε4 аллель из аполипопротеин E (APOE).[45][46] От 40 до 80% людей с БА обладают по крайней мере одним аллелем APOEε4.[46] Аллель APOEε4 увеличивает риск заболевания в три раза у гетерозигот и в 15 раз у гомозигот.[40] Как и многие болезни человека, воздействие окружающей среды и генетические модификаторы приводят к неполному пенетрантность. Например, в некоторых популяциях Нигерии не наблюдается взаимосвязи между дозой APOEε4 и заболеваемостью или возрастом начала болезни Альцгеймера, наблюдаемой в других популяциях людей.[47][48] Ранние попытки скрининга до 400 генов-кандидатов на связь со спорадической БА с поздним началом (НАГРУЗКА) привели к низкому результату.[40][41] Более свежий полногеномные ассоциации исследований (GWAS) обнаружили 19 областей в генах, которые, по-видимому, влияют на риск.[49] Эти гены включают: CASS4, CELF1, FERMT2, HLA-DRB5, INPP5D, MEF2C, NME8, PTK2B, SORL1, ZCWPW1, SLC24A4, CLU, PICALM, CR1, BIN1, MS4A, ABCA7, EPHA1, и CD2AP.[49]
Аллели в TREM2 были связаны с повышением риска развития болезни Альцгеймера в 3-5 раз.[50][51] Предполагаемый механизм действия состоит в том, что в некоторых вариантах TREM2 лейкоциты в головном мозге больше не могут контролировать количество присутствующего бета-амилоида. Много однонуклеотидные полиморфизмы (SNP) связаны с болезнью Альцгеймера: в исследовании 2018 года добавлено 30 SNP, дифференцируя AD на 6 категорий, включая память, язык, зрительно-пространственное и исполнительное функционирование.[52]
Холинергическая гипотеза
Самая старая гипотеза, на которой основано большинство доступных в настоящее время лекарств, - это холинергический гипотеза,[53] который предполагает, что AD вызвана сниженным синтезом нейротрансмиттер ацетилхолин. Холинергическая гипотеза не получила широкой поддержки, в основном потому, что лекарства, предназначенные для лечения дефицита ацетилхолина, были не очень эффективны.[54]
Амилоидная гипотеза
В 1991 г. амилоид гипотеза постулировал, что внеклеточный бета-амилоид (Aβ) отложения являются основной причиной заболевания.[55][56] Подтверждением этого постулата является расположение гена белок-предшественник амилоида (APP) на хромосома 21, вместе с тем, что люди с трисомия 21 (Синдром Дауна) у которых есть лишняя копия гена почти всегда проявляются, по крайней мере, самые ранние симптомы AD к 40 годам.[57][58] Кроме того, конкретный изоформа аполипопротеина, APOE4, является основным генетическим фактором риска AD. Хотя аполипопротеины усиливают расщепление бета-амилоида, некоторые изоформы не очень эффективны для этой задачи (например, APOE4), что приводит к избыточному накоплению амилоида в головном мозге.[59] Дальнейшие доказательства получены из вывода, что трансгенный у мышей, экспрессирующих мутантную форму гена АРР человека, развиваются фибриллярные амилоидные бляшки и патология головного мозга, подобная болезни Альцгеймера, с дефицитом пространственного обучения.[60]
В ранних испытаниях на людях было обнаружено, что экспериментальная вакцина очищает амилоидные бляшки, но не оказала существенного влияния на деменцию.[61] Исследователи пришли к выводу, что подозрение на отсутствие зубного налета Аβ олигомеры (агрегаты многих мономеров) как первичная патогенная форма Aβ. Эти токсичные олигомеры, также называемые диффузными лигандами амилоидного происхождения (ADDL), связываются с поверхностным рецептором на нейронах и изменяют структуру синапса, тем самым нарушая нейронную связь.[62] Один рецептор для Aβ олигомеры могут быть прионный белок, тот же белок, который был связан с коровье бешенство и связанное с этим состояние человека, Болезнь Крейтцфельдта-Якоба, таким образом потенциально связывая основной механизм этих нейродегенеративный расстройства с болезнью Альцгеймера.[63]
В 2009 году эта гипотеза была обновлена, предполагая, что близкий родственник бета-амилоидного белка, а не обязательно сам бета-амилоид, может быть основным виновником болезни. Гипотеза утверждает, что связанный с амилоидом механизм, который сокращает нейронные связи в мозге в фазе быстрого роста в раннем возрасте, может быть запущен связанными со старением процессами в более позднем возрасте, чтобы вызвать увядание нейронов при болезни Альцгеймера.[64] N-APP, фрагмент APP из пептида N-конец, соседствует с бета-амилоидом и отщепляется от АРР одним из тех же ферментов. N-APP запускает путь самоуничтожения путем связывания с нейрональным рецептором, называемым рецептором смерти 6 (DR6, также известным как TNFRSF21 ).[64] DR6 высоко экспрессируется в областях человеческого мозга, наиболее пораженных болезнью Альцгеймера, поэтому вполне возможно, что путь N-APP / DR6 может быть захвачен в стареющий мозг нанести ущерб. В этой модели бета-амилоид играет дополнительную роль, подавляя синаптическую функцию.
Осака мутация
Было обнаружено, что японская родословная семейной болезни Альцгеймера связана с делеционной мутацией кодона 693 АРР.[65] Об этой мутации и ее связи с болезнью Альцгеймера впервые было сообщено в 2008 году.[66] Эта мутация известна как мутация Осаки. Только у гомозигот с этой мутацией развивается болезнь Альцгеймера. Эта мутация ускоряет олигомеризацию Aβ, но белки не образуют амилоидные фибриллы, что позволяет предположить, что причиной этого заболевания может быть олигомеризация Aβ, а не фибриллы. Мыши, экспрессирующие эту мутацию, имеют все обычные патологии болезни Альцгеймера.
Гипотеза тау

В гипотеза тау предлагает, чтобы тау-белок аномалии инициируют каскад болезней.[56] В этой модели гиперфосфорилированный тау начинает соединяться с другими нитями тау. В итоге они образуют нейрофибриллярные сплетения внутри тел нервных клеток.[67] Когда это происходит, микротрубочки распадаются, разрушая структуру клетки цитоскелет который разрушает транспортную систему нейрона.[68] Это может привести сначала к сбоям в биохимической коммуникации между нейронами, а затем к гибели клеток.[69]
Другие гипотезы
Воспалительная гипотеза состоит в том, что AD возникает из-за самовоспроизводящегося прогрессирующего воспаления в головном мозге, кульминацией которого является нейродегенерация.[70] Возможная роль хронического пародонтальный инфекционное заболевание[70] и кишечная микробиота было предложено.[71]
Была предложена нейрососудистая гипотеза, согласно которой плохое функционирование гематоэнцефалический барьер могут быть задействованы.[72] Спирохетные инфекции также были связаны с деменцией.[73][74]
Сотовый гомеостаз из биометаллы такие как ионная медь, железо и цинк, нарушается при AD, хотя остается неясным, продуцируется ли это или вызывает изменения в белках. Эти ионы влияют и на них влияют тау, APP и APOE,[75] и их нарушение регуляции может вызвать окислительный стресс что может способствовать развитию патологии.[76][77][78][79][80] Качество некоторых из этих исследований подвергалось критике,[81][82] и связь остается спорной.[83] Большинство исследователей не поддерживают причинную связь с алюминием.[82]
Курение является значительным фактором риска БА.[84] Системные маркеры из врожденная иммунная система являются факторами риска позднего начала AD.[85]
Есть предварительные доказательства того, что воздействие загрязнение воздуха может быть фактором, способствующим развитию болезни Альцгеймера.[86]
Одна из гипотез утверждает, что дисфункция олигодендроциты и связанный с ними миелин во время старения способствует повреждению аксонов, которое затем вызывает выработку амилоида и гиперфосфорилирование тау-белка в качестве побочного эффекта.[87][88]
Ретрогенез - это медицинское гипотеза о развитии и прогрессе болезни Альцгеймера, предложенном Барри Рейсбергом в 1980-х годах.[89] Гипотеза состоит в том, что так же, как плод проходит через процесс развитие нервной системы начиная с нейруляция и заканчивая миелинизация, мозг людей с AD проходит обратный нейродегенерация процесс, начинающийся с демиелинизация и гибель аксонов (белого вещества) и заканчивая гибелью серого вещества.[90] Точно так же гипотеза состоит в том, что младенцы проходят через состояния когнитивное развитие, люди с AD проходят процесс, обратный прогрессивному когнитивные нарушения.[89] Райсберг разработал инструмент оценки ухода за больными, известный как «FAST» (инструмент определения стадии функциональной оценки), который, по его словам, позволяет лицам, ухаживающим за людьми с БА, определять стадии прогрессирования заболевания и дает советы о том, какой уход необходим на каждой стадии.[89][91]
Связь с глютеновая болезнь неясно: исследование 2019 года не обнаружило увеличения деменции в целом у людей с CD, в то время как обзор 2018 года обнаружил связь с несколькими типами деменции, включая AD.[92][93]
Патофизиология

Невропатология
Болезнь Альцгеймера характеризуется потерей нейроны и синапсы в кора головного мозга и определенные подкорковые области. Эта потеря приводит к валовой атрофия пораженных областей, включая дегенерацию в височная доля и теменная доля, и части лобная кора и поясная извилина.[94] Дегенерация также присутствует в ядрах ствола мозга, таких как голубое пятно.[95] Исследования с использованием МРТ и ДОМАШНИЙ ПИТОМЕЦ документально подтвердили уменьшение размера определенных областей мозга у людей с БА по мере того, как они прогрессировали от легкого когнитивного нарушения до болезни Альцгеймера, и по сравнению с аналогичными изображениями от здоровых пожилых людей.[96][97]
Обе амилоидные бляшки и нейрофибриллярные сплетения хорошо видны микроскопия в мозгах больных AD,[98] особенно в гиппокамп.[99] Бляшки плотные, в основном нерастворимый депозиты бета-амилоид пептид и сотовый материал снаружи и вокруг нейронов. Клубки (нейрофибриллярные клубки) представляют собой агрегаты ассоциированного с микротрубочками белка тау, который стал гиперфосфорилированным и накапливается внутри самих клеток. Хотя у многих пожилых людей в результате старения появляются бляшки и клубки, в мозгу людей с БА их больше в определенных областях мозга, таких как височная доля.[100] Тела Леви не редкость в мозгу людей с AD.[101]
Биохимия
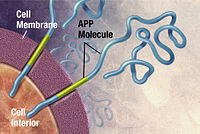


Болезнь Альцгеймера была определена как неправильная упаковка белка болезнь (протеопатия ), вызванный бляшка скопление аномально сложенных амилоид бета белок и тау белок в головном мозге.[102] Бляшки состоят из мелких пептиды, 39–43 аминокислоты в длину, называется амилоид бета (Аβ). Аβ это фрагмент из большего белок-предшественник амилоида (ПРИЛОЖЕНИЕ). APP - это трансмембранный белок который проникает через мембрану нейрона. APP имеет решающее значение для роста нейронов, их выживания и восстановления после травм.[103][104] При болезни Альцгеймера гамма-секретаза и бета-секретаза действовать вместе в протеолитический процесс, который приводит к разделению APP на более мелкие фрагменты.[105] Один из этих фрагментов дает начало фибриллам бета-амилоида, которые затем образуют сгустки, которые откладываются вне нейронов в плотные образования, известные как старческие бляшки.[98][106]
AD также считается таупатия из-за ненормальной агрегации тау-белок. Каждый нейрон имеет цитоскелет, внутренняя опорная конструкция, частично состоящая из структур, называемых микротрубочки. Эти микротрубочки действуют как дорожки, направляя питательные вещества и молекулы от тела клетки к концам аксон и назад. Белок под названием тау стабилизирует микротрубочки, когда фосфорилированный, и поэтому называется белок, связанный с микротрубочками. При БА тау претерпевает химические изменения, становясь гиперфосфорилированный; затем он начинает соединяться с другими потоками, создавая нейрофибриллярные сплетения и разрушение транспортной системы нейрона.[107] Патогенный тау-белок также может вызывать гибель нейронов через сменный элемент нарушение регуляции.[108]
Механизм болезни
Неизвестно, как именно нарушения производства и агрегации бета-амилоидного пептида вызывают патологию БА.[109][110]Гипотеза амилоида традиционно указывает на накопление бета-амилоида. пептиды как центральное событие, вызывающее дегенерацию нейронов. Накопление агрегированного амилоида фибриллы, которые считаются токсичной формой белка, ответственного за нарушение клеточного кальций ион гомеостаз, побуждает запрограммированная гибель клеток (апоптоз ).[111] Также известно, что Aβ выборочно накапливается в митохондрии в клетках мозга, пораженного болезнью Альцгеймера, а также подавляет некоторые фермент функции и использование глюкоза нейронами.[112]
Различные воспалительные процессы и цитокины также может играть роль в патологии болезни Альцгеймера. Воспаление является общим маркером ткань повреждение при любом заболевании и может быть вторичным по отношению к повреждению тканей при БА или маркером иммунологического ответа.[113] Появляется все больше свидетельств сильного взаимодействия между нейронами и иммунологическими механизмами мозга. Ожирение и системное воспаление могут влиять на иммунологические процессы, способствующие прогрессированию заболевания.[114]
Изменения в раздаче разных нейротрофические факторы и в экспрессии их рецепторов, таких как нейротрофический фактор головного мозга (BDNF) были описаны в AD.[115][116]
Диагностика

Болезнь Альцгеймера обычно диагностируется на основании история болезни, анамнез от родственников и поведенческие наблюдения. Наличие характерного неврологический и нейропсихологический особенности и отсутствие альтернативных условий поддерживает.[117][118] Передовой медицинская визуализация с компьютерная томография (CT) или магнитно-резонансная томография (МРТ), а с однофотонная эмиссионная компьютерная томография (ОФЭКТ) или позитронно-эмиссионная томография (ПЭТ) можно использовать для исключения других церебральных патологий или подтипов деменции.[119] Более того, он может предсказать конверсию из продромальный стадии (легкие когнитивные нарушения) болезни Альцгеймера.[120]
Оценка интеллектуального функционирования в том числе тестирование памяти может дополнительно охарактеризовать состояние болезни.[22] Медицинские организации создали диагностические критерии, чтобы упростить и стандартизировать диагностический процесс для практикующих врачей. Диагноз можно подтвердить с очень высокой точностью. вскрытие когда материал мозга доступен и может быть исследован гистологически.[121]
Критерии
В Национальный институт неврологических и коммуникативных расстройств и инсульта (NINCDS) и Ассоциация болезни Альцгеймера и связанных с ней заболеваний (ADRDA, теперь известная как Ассоциация Альцгеймера ) установлены наиболее часто используемые NINCDS-ADRDA Критерии Альцгеймера для диагностики в 1984 г.,[121] обширно обновлен в 2007 году.[122] Эти критерии требуют наличия когнитивные нарушения, и подозрение на синдром деменции, должны быть подтверждены нейропсихологическое тестирование для клинического диагноза возможной или вероятной AD. А гистопатологический подтверждение, включая микроскопический экспертиза ткани мозга требуется для окончательного диагноза. Хороший статистическая надежность и срок действия оказались между диагностическими критериями и окончательным гистопатологическим подтверждением.[123] Восемь интеллектуальных областей чаще всего нарушаются при AD:объем памяти, язык, навыки восприятия, внимание, двигательные навыки, ориентация, решение проблем и исполнительный функционал способности. Эти домены эквивалентны критериям Альцгеймера NINCDS-ADRDA, перечисленным в Диагностическое и Статистическое Руководство по Психическим Расстройствам (DSM-IV-TR) опубликовано Американская психиатрическая ассоциация.[124][125]
Методы

Нейропсихологические тесты такой как мини-обследование психического состояния (MMSE) широко используются для оценки когнитивных нарушений, необходимых для диагностики. Для высокой надежности результатов, особенно на самых ранних стадиях болезни, необходимы более полные наборы тестов.[126][127] Неврологическое обследование на ранних стадиях БА обычно дает нормальные результаты, за исключением очевидных когнитивных нарушений, которые могут не отличаться от тех, которые возникают в результате других заболеваний, включая другие причины деменции.
Дальнейшие неврологические обследования имеют решающее значение для дифференциальная диагностика БА и других заболеваний.[22] Интервью с членами семьи также используются для оценки заболевания. Лица, осуществляющие уход, могут предоставить важную информацию о повседневных способностях к жизни, а также о снижении со временем умственная функция.[128] Точка зрения лица, осуществляющего уход, особенно важна, поскольку человек с БА обычно не осознает своего собственного дефицит.[129] Часто семьи также сталкиваются с трудностями при обнаружении начальных симптомов деменции и могут не передавать точную информацию врачу.[130]
Дополнительное тестирование дает дополнительную информацию о некоторых особенностях заболевания или используется для исключения других диагнозов. Анализы крови может выявить другие причины деменции, кроме AD[22]- причины, которые в редких случаях могут быть обратимыми.[131] Обычно выполняют тесты функции щитовидной железы, оценивать B12, исключать сифилис, исключить метаболические проблемы (включая тесты на функцию почек, уровень электролитов и диабет), оценить уровень тяжелых металлов (например, свинца, ртути) и анемии. (Также необходимо исключить бред ).
Психологические тесты за депрессия используются, поскольку депрессия может сочетаться с БА (см. Депрессия болезни Альцгеймера ), ранний признак когнитивных нарушений,[132] или даже причина.[133][134]
Из-за низкой точности сканирование C-PIB-PET не рекомендуется использовать в качестве инструмента ранней диагностики или для прогнозирования развития болезни Альцгеймера, когда у людей появляются признаки умеренного когнитивного нарушения (MCI).[135] Использование 18ПЭТ-сканирование с F-FDG как единый тест для выявления людей, у которых может развиться болезнь Альцгеймера, также не подтверждено доказательствами.[136]
Профилактика

Нет убедительных доказательств того, что какая-либо конкретная мера эффективна для предотвращения БА.[13] Глобальные исследования мер по предотвращению или отсрочке возникновения БА часто давали противоречивые результаты. Эпидемиологические исследования предлагали взаимосвязь между определенными модифицируемыми факторами, такими как диета, сердечно-сосудистый риск, фармацевтические продукты или интеллектуальная деятельность среди других, и вероятностью развития населения. ОБЪЯВЛЕНИЕ. Только дальнейшие исследования, включая клинические испытания, покажут, могут ли эти факторы помочь предотвратить AD.[13]
Медикамент
Факторы сердечно-сосудистого риска, такие как гиперхолестеринемия, гипертония, сахарный диабет, и курение, связаны с более высоким риском начала и ухудшения течения БА.[137][138] Лекарства от кровяного давления могут снизить риск.[139] Статины, которые ниже холестерин тем не менее, они не были эффективны в предотвращении или улучшении течения болезни.[140][141][142]
Долгосрочное использование нестероидные противовоспалительные препараты (НПВП) в 2007 г. считалось, что они связаны с пониженной вероятностью развития БА.[143] Имеющиеся данные также подтверждают идею о том, что НПВП могут уменьшить воспаление относится к амилоидные бляшки, но испытания были приостановлены из-за большого количества побочных эффектов.[13] Никаких профилактических испытаний не завершено.[13] Они не кажутся полезными в качестве лечения, но по состоянию на 2011 г.[Обновить] считались кандидатами в качестве пресимптоматических профилактических средств.[144] Заместительная гормональная терапия при климаксе, хотя ранее использовался, может увеличить риск деменции.[145]
Стиль жизни
Люди, которые занимаются интеллектуальной деятельностью, например чтение, играя настольные игры, завершая кроссворды, играя музыкальные инструменты, или обычный социальное взаимодействие показывают снижение риска болезни Альцгеймера.[146] Это совместимо с когнитивный резерв теория, которая утверждает, что некоторые жизненные опыты приводят к более эффективному функционированию нервной системы, обеспечивая человеку когнитивный резерв, который задерживает начало проявлений деменции.[146] Образование задерживает наступление синдрома АД без изменения длительности заболевания.[147] Изучение второй язык даже в более позднем возрасте, кажется, отсрочивает начало болезни Альцгеймера.[148]Физическая активность также связано с уменьшением риска AD.[147] Физические упражнения связаны со снижением уровня деменции.[149] Физические упражнения также эффективны для уменьшения выраженности симптомов у людей с болезнью Альцгеймера.[150]
Рацион питания
Люди, поддерживающие здоровый, Японский, или же средиземноморская диета имеют пониженный риск AD.[151] Средиземноморская диета может улучшить результаты у людей с этим заболеванием.[152] Те, кто придерживается диеты с высоким содержанием насыщенные жиры и простые углеводы (мононуклеоз- и дисахарид ) имеют более высокий риск.[153] Благоприятный сердечно-сосудистый эффект средиземноморской диеты был предложен в качестве механизма действия.[154]
Иногда бывает трудно сделать выводы о диетических компонентах, поскольку результаты популяционных исследований и рандомизированных контролируемых исследований различались.[151] Имеются ограниченные данные о том, что употребление алкоголя от легкого до умеренного, особенно красное вино, связано с более низким риском AD.[151] Есть предварительные доказательства того, что кофеин может быть защитным.[155] Ряд продуктов с высоким содержанием флавоноиды Такие как какао, красное вино и чай может снизить риск AD.[156][157]
Обзоры использования витамины а минералы не нашли достаточно убедительных доказательств, чтобы рекомендовать их. Сюда входит витамин А,[158][159] C,[160][161] альфа-токоферольная форма витамина Е,[162] селен,[163] цинк,[164][165] и фолиевая кислота с витамином B или без него12.[166] Данные одного рандомизированного контролируемого исследования показали, что альфа-токоферольная форма витамина E может замедлять снижение когнитивных функций, качество этих доказательств было оценено как «умеренное».[162] Рассмотрение судебных процессов фолиевая кислота (B9) и другие витамины группы B не показали какой-либо значительной связи со снижением когнитивных функций.[167] Добавки омега-3 жирных кислот из растений и рыбы, а также диетические докозагексаеновая кислота (DHA), по-видимому, не приносит пользы людям с болезнью Альцгеймера от легкой до умеренной.[168][169]
Куркумин с 2010 г.[Обновить] не показал положительных результатов на людях, хотя имеются предварительные доказательства на животных.[170] Существовали противоречивые и неубедительные доказательства того, что гинкго оказывает положительное влияние на когнитивные нарушения и слабоумие.[171] По состоянию на 2008 г.[Обновить] не было никаких конкретных доказательств того, что каннабиноиды эффективны для улучшения симптомов болезни Альцгеймера или деменции;[172] однако некоторые исследования эндоканнабиноидов выглядели многообещающими.[173]
Управление
От болезни Альцгеймера нет лекарства; доступные методы лечения предлагают относительно небольшую симптоматическую пользу, но остаются паллиативный в природе. Текущие методы лечения можно разделить на фармацевтические, психосоциальные и лечебные.
Лекарства


В настоящее время для лечения когнитивных проблем БА используются пять лекарств: четыре из них. ингибиторы ацетилхолинэстеразы (такрин, ривастигмин, галантамин и донепезил ) и другие (мемантин ) является Антагонист рецептора NMDA. Польза от их использования небольшая.[174][175][176] Не было явных доказательств того, что лекарства замедляют или останавливают прогрессирование заболевания.
Снижение активности холинергический нейроны - хорошо известная особенность болезни Альцгеймера.[177] Ингибиторы ацетилхолинэстеразы используются для снижения скорости, с которой ацетилхолин (ACh) расщепляется, тем самым увеличивая концентрацию ACh в головном мозге и борясь с потерей ACh, вызванной гибелью холинергических нейронов.[178] Имеются данные об эффективности этих препаратов при болезни Альцгеймера легкой и средней степени тяжести.[179][175][174] и некоторые доказательства их использования на продвинутой стадии.[174] Применение этих препаратов в легкие когнитивные нарушения не показал никакого эффекта в задержке начала AD.[180] Самый распространенный побочные эффекты находятся тошнота и рвота, оба из которых связаны с холинергическим избытком. Эти побочные эффекты возникают примерно у 10–20% пользователей, от легкой до умеренной степени тяжести, и с ними можно справиться, медленно корректируя дозы лекарств.[181] Менее распространенные побочные эффекты включают мышцы судороги, уменьшилось частота сердцебиения (брадикардия ), уменьшилось аппетит и вес, и увеличился Желудочный сок производство.[179]
Глутамат возбуждает нейротрансмиттер из нервная система, хотя чрезмерные количества в мозг может привести к клетка смерть через процесс, называемый эксайтотоксичность который состоит из чрезмерной стимуляции глутамата рецепторы. Эксайтотоксичность возникает не только при болезни Альцгеймера, но и при других неврологических заболеваниях, таких как болезнь Паркинсона и рассеянный склероз.[182] Мемантин неконкурентоспособный Антагонист рецептора NMDA впервые использовался как анти-грипп агент. Он действует на глутаматергическая система путем блокировки Рецепторы NMDA и подавление их чрезмерной стимуляции глутаматом.[182][183] Было показано, что мемантин имеет небольшое преимущество при лечении умеренной и тяжелой болезни Альцгеймера.[184] Сообщаемые нежелательные явления при приеме мемантина нечасты и легки, в том числе: галлюцинации, путаница, головокружение, Головная боль и усталость.[185] Было показано, что комбинация мемантина и донепезила «из статистически значимый но клинически предельная эффективность ».[186]
Атипичные нейролептики умеренно полезны для сокращения агрессия и психоз у людей с болезнью Альцгеймера, но их преимущества компенсируются серьезными побочными эффектами, такими как Инсульт, трудности передвижения или когнитивный спад.[187] Было показано, что при длительном использовании они вызывают повышенную смертность.[188] Прекращение использования антипсихотических препаратов в этой группе людей кажется безопасным.[189]
Психосоциальное вмешательство
Психосоциальный вмешательства используются в качестве дополнения к фармацевтическому лечению и могут быть классифицированы по подходам, ориентированным на поведение, эмоции, познание или стимуляцию. Исследования эффективности недоступны и редко специфичны для БА, вместо этого сосредоточены на деменции в целом.[190]
Поведенческие вмешательства попытаться определить и уменьшить антецеденты и последствия проблемного поведения. Этот подход не показал успеха в улучшении общего функционирования,[191] но может помочь уменьшить некоторые специфические проблемы поведения, такие как недержание мочи.[192] Отсутствуют качественные данные об эффективности этих методов при решении других проблем поведения, таких как блуждание.[193][194] Музыкальная терапия эффективна для уменьшения поведенческих и психологических симптомов.[195]
Эмоционально-ориентированные вмешательства включают: реминисцентная терапия, валидационная терапия, поддерживающий психотерапия, сенсорная интеграция, также называемый сноэзелен, и терапия имитации присутствия. Кокрановский обзор не нашел доказательств того, что это эффективно.[196] Поддерживающая психотерапия практически не получила официального научного исследования, но некоторые врачи считают ее полезной, помогая людям с легкими нарушениями приспособиться к своей болезни.[190] Терапия воспоминаниями (RT) включает обсуждение прошлого опыта индивидуально или в группе, много раз с помощью фотографий, предметов домашнего обихода, музыки и звукозаписей или других знакомых предметов из прошлого. Обзор эффективности ЛТ в 2018 году показал, что эффекты были непоследовательными, небольшими по размеру и сомнительной клинической значимостью и варьировались в зависимости от условий.[197] Терапия имитации присутствия (SPT) основана на теории привязанности и включает воспроизведение записи с голосами ближайших родственников человека с болезнью Альцгеймера. Есть частичные доказательства того, что SPT может уменьшить вызывающее поведение.[198]Наконец, валидационная терапия основана на принятии реальности и личной правды о чужом опыте, в то время как сенсорная интеграция основана на упражнениях, направленных на стимулирование чувства. Нет никаких доказательств, подтверждающих полезность этих методов лечения.[199][200]
Цель лечения, ориентированного на познание, которое включает ориентацию на реальность и когнитивная переподготовка, это уменьшение когнитивные нарушения. Ориентация на реальность заключается в представлении информации о времени, месте или человеке, чтобы облегчить понимание человеком своего окружения и своего места в нем. С другой стороны, когнитивная переподготовка пытается улучшить ослабленные способности за счет тренировки умственных способностей. Оба показали некоторую эффективность в улучшении когнитивных способностей,[201] хотя в некоторых исследованиях эти эффекты были временными, и также сообщалось о негативных эффектах, таких как разочарование.[190]
Лечение, ориентированное на стимуляцию, включает: Изобразительное искусство, Музыка и домашний питомец терапии, упражнение, и любые другие развлекательные мероприятия. Стимуляция в некоторой степени способствует улучшению поведения, настроения и, в меньшей степени, функций. Тем не менее, какими бы важными ни были эти эффекты, основным аргументом в пользу использования стимулирующей терапии является изменение распорядка дня.[190]
Уход
Поскольку болезнь Альцгеймера неизлечима и постепенно делает людей неспособными заботиться о своих нуждах, уход - это, по сути, лечение, и с ним необходимо тщательно обращаться в течение болезни.
На ранних и умеренных стадиях изменения в среде обитания и образе жизни могут увеличиваться. безопасность пациента и уменьшить нагрузку на ухаживающих.[202][203] Примерами таких модификаций являются соблюдение упрощенных процедур, установка предохранительных замков, маркировка предметов домашнего обихода, чтобы указать человеку, больному болезнью, или использование модифицированных предметов повседневной жизни.[190][204][205] Если есть проблемы с приемом пищи, пищу нужно готовить небольшими кусочками или даже протирать.[206] Когда трудности с глотанием возникают, использование питательные трубки может потребоваться. В таких случаях медицинская эффективность и этика продолжения кормления являются важным аспектом для лиц, осуществляющих уход, и членов семьи.[207][208] Использование физических средств сдерживания редко показано на какой-либо стадии заболевания, хотя бывают ситуации, когда они необходимы, чтобы предотвратить нанесение вреда человеку с БА или его опекунам.[190]
По мере прогрессирования болезни могут появляться различные проблемы со здоровьем, например: стоматологические и стоматологические заболевания, пролежни, недоедание, гигиена проблемы, или респираторный, кожа, или же глаз инфекции. Тщательное лечение может предотвратить их, а в случае их возникновения необходимо профессиональное лечение.[209][210] На последних стадиях заболевания лечение направлено на облегчение дискомфорта до смерти, часто с помощью хоспис.[211]
Прогноз

Ранние стадии болезни Альцгеймера сложно диагностировать. Окончательный диагноз обычно ставится, когда когнитивные нарушения ставят под угрозу повседневную жизнедеятельность, хотя человек может по-прежнему жить самостоятельно. Симптомы будут прогрессировать от легких когнитивных проблем, таких как потеря памяти, до нарастающих стадий когнитивных и некогнитивных нарушений, что исключает любую возможность самостоятельной жизни, особенно на поздних стадиях болезни.[29]
Продолжительность жизни людей с AD уменьшается.[212] После постановки диагноза он обычно составляет от трех до десяти лет.[212]
Менее 3% людей живут более четырнадцати лет.[213] Особенности заболевания, в значительной степени связанные с уменьшением выживаемости, - это повышенная тяжесть когнитивных нарушений, снижение функционального уровня, падения в анамнезе и нарушения неврологического обследования. Другие сопутствующие заболевания, такие как проблемы с сердцем, сахарный диабет или история злоупотребление алкоголем также связаны с сокращением выживаемости.[214][215][216] Несмотря на то, что чем раньше наступает возраст, тем выше общее количество лет выживания, продолжительность жизни особенно снижается по сравнению со здоровым населением среди тех, кто моложе.[217] Прогноз выживаемости у мужчин менее благоприятен, чем у женщин.[213][218]
Пневмония и обезвоживание являются наиболее частыми непосредственными причинами смерти от АД, в то время как рак является менее частой причиной смерти, чем среди населения в целом.[218]
Эпидемиология
| Возраст | Новый пострадавший за тысячу человеко-годы |
|---|---|
| 65–69 | 3 |
| 70–74 | 6 |
| 75–79 | 9 |
| 80–84 | 23 |
| 85–89 | 40 |
| 90– | 69 |
Два основных показателя используются в эпидемиологический исследования: заболеваемость и распространенность. Заболеваемость - количество новых случаев на единицу человеко-времени в группе риска (обычно количество новых случаев на тысячу человеко-лет); пока распространенность - общее количество случаев заболевания среди населения в любой момент времени.
Что касается заболеваемости, когорта лонгитюдные исследования (исследования, в которых на протяжении многих лет наблюдается популяция, свободная от болезней) дают показатели от 10 до 15 на тысячу человеко-лет для всех деменций и 5-8 для AD,[219][220] Это означает, что половина новых случаев деменции ежегодно приходится на AD. Пожилой возраст является основным фактором риска заболевания, и показатели заболеваемости не одинаковы для всех возрастов: каждые пять лет после 65 лет риск заражения увеличивается примерно вдвое, увеличиваясь с 3 до 69 на тысячу человеко-лет. .[219][220] Существуют также половые различия в уровне заболеваемости: женщины имеют более высокий риск развития БА, особенно среди населения старше 85 лет.[220][221] в Соединенные Штаты, риск смерти от болезни Альцгеймера среди неиспаноязычного белого населения на 26% выше, чем среди неиспаноязычного черного населения, тогда как среди испаноязычного населения риск на 30% ниже, чем среди неиспаноязычного белого населения.[222]

Распространенность БА среди населения зависит от различных факторов, включая заболеваемость и выживаемость. Поскольку частота БА увеличивается с возрастом, особенно важно включить средний возраст интересующей популяции. В Соединенных Штатах распространенность болезни Альцгеймера в 2000 г. оценивалась в 1,6% как в целом, так и в возрастной группе 65–74 лет, с увеличением до 19% в группе 75–84 лет и до 42% в группе старше 84 лет.[223] Показатели распространенности в менее развитых регионах ниже.[224] В Всемирная организация здоровья по оценкам, в 2005 году 0,379% людей во всем мире страдали деменцией, и что распространенность этого заболевания увеличится до 0,441% в 2015 году и до 0,556% в 2030 году.[225] Другие исследования пришли к аналогичным выводам.[224] Другое исследование показало, что в 2006 г. 0,40% населения мира (диапазон 0,17–0,89%; абсолютное число 26,6 миллиона, классифицировать 11,4–59,4 миллиона) были поражены БА, и что показатель распространенности утроится, а абсолютное число увеличится в четыре раза к 2050 году.[226]
История

В древнегреческий и римский философы и врачи ассоциируется старость с увеличением слабоумие.[18] Только в 1901 году немецкий психиатр Алоис Альцгеймер выявил первый случай болезни Альцгеймера, названной в его честь, у пятидесятилетней женщины, которую он назвал Огюст Д.. Он следил за ее делом, пока она не умерла в 1906 году, когда впервые публично сообщил об этом.[227] В течение следующих пяти лет было зарегистрировано одиннадцать подобных случаев в медицинская литература, некоторые из них уже используют термин болезнь Альцгеймера.[18] Заболевание было впервые описано как самостоятельное заболевание Эмиль Крепелин после подавления некоторых клинических (бред и галлюцинации) и патологических признаков (артериосклеротические изменения), содержащихся в первоначальном отчете Огюста Д.[228] Он включил Болезнь Альцгеймера, также названный презренный слабоумие Крепелина, как подтип старческое слабоумие в восьмом издании его Учебник психиатрии, Опубликован в 15 июля, 1910.[229]
На протяжении большей части 20-го века диагноз болезни Альцгеймера ставился только для людей в возрасте от 45 до 65 лет, у которых развились симптомы деменции. Терминология изменилась после 1977 года, когда конференция по AD пришла к выводу, что клинические и патологический проявления пресенильной и старческой деменции были практически идентичны, хотя авторы также добавили, что это не исключает возможности того, что они имели разные причины.[230] В конечном итоге это привело к диагнозу: Болезнь Альцгеймера независимо от возраста.[231] Период, термин старческое слабоумие типа Альцгеймера (SDAT) какое-то время использовался для описания состояния у людей старше 65 лет, а классическая болезнь Альцгеймера использовалась для описания тех, кто был моложе. В конце концов, термин болезнь Альцгеймера был официально принят в медицине. номенклатура для описания людей любого возраста с характерной общей картиной симптомов, течением болезни и невропатология.[232]
Общество и культура
Социальные издержки
Деменция, в частности болезнь Альцгеймера, может быть одной из самых дорогостоящих болезней для общества в Европа и Соединенные Штаты,[19][20] в то время как их расходы в других странах, таких как Аргентина,[233] и Южная Корея,[234] тоже высокие и растущие. Эти затраты, вероятно, будут увеличиваться со старением общества, становясь важным фактором. социальная проблема. Затраты, связанные с AD, включают прямые медицинские расходы, такие как: дом престарелых, прямые немедицинские расходы, например, на дому дневной уход, и косвенные затраты, такие как потеря продуктивность как пациента, так и опекуна.[20] В разных исследованиях цифры различаются, но мировые затраты на деменцию оцениваются примерно в 160 миллиардов долларов.[235] в то время как цена болезни Альцгеймера в Соединенных Штатах может составлять 100 миллиардов долларов в год.[20]
Самый большой источник издержек для общества - это длительный уход к медицинские работники и особенно институционализация, что соответствует 2/3 общих затрат общества.[19] Стоимость проживания дома тоже очень высокий,[19] особенно с учетом неформальных затрат семьи, таких как время ухода и потерянный заработок опекуна.[236]
Затраты увеличиваются с увеличением степени деменции и наличия поведенческих нарушений,[237] и связаны с увеличением времени ухода, необходимого для оказания физической помощи.[236] Следовательно, любое лечение, замедляющее снижение когнитивных способностей, отсрочивающее помещение в лечебное учреждение или сокращающее часы ухода за больными, будет иметь экономические преимущества. Экономические оценки существующих методов лечения дали положительные результаты.[20]
Бремя ухода
Роль главного опекун часто принимает супруга или близкий родственник.[238] Известно, что болезнь Альцгеймера ложится тяжелым бременем на сиделки который включает социальные, психологические, физические или экономические аспекты.[14][239][240] Домашний уход обычно предпочитают люди с AD и их семьи.[241] Этот вариант также отсрочивает или устраняет необходимость в более профессиональном и дорогостоящем уровне обслуживания.[241][242] Тем не менее, две трети обитателей домов престарелых страдают деменцией.[190]
Слабоумие лица, осуществляющие уход, подвергаются высоким нормам физического и умственный расстройства.[243] Факторы, связанные с более серьезными психосоциальными проблемами у лиц, осуществляющих первичный уход, включают в себя наличие пострадавшего дома, когда лицо, осуществляющее уход, является супругом, требовательное поведение человека, за которым осуществляется уход, такое как депрессия, поведенческие нарушения, галлюцинации, проблемы со сном или нарушения ходьбы и социальная изоляция.[244][245] Что касается экономических проблем, члены семьи, осуществляющие уход, часто отказываются от работы, чтобы проводить в среднем 47 часов в неделю с человеком с АД, в то время как расходы на уход за ним высоки. Прямые и косвенные затраты на уход за пациентом, страдающим болезнью Альцгеймера, составляют в среднем от 18 000 до 77 500 долларов США в год в Соединенных Штатах, в зависимости от исследования.[236][238]
Когнитивно-поведенческая терапия и обучение стратегии выживания индивидуально или в группе продемонстрировали свою эффективность в улучшении психологического здоровья лиц, осуществляющих уход.[14][246]
Средства массовой информации
AD изображался в таких фильмах, как: Ирис (2001), на основе Джон Бэйли мемуары его жены Айрис Мердок;[247] Записная книжка (2004), на основе Николас Спаркс ' 1996 роман с таким же названием;[248] Момент, чтобы помнить (2004); Танматра (2005);[249] Воспоминания о завтрашнем дне (Ашита но Киоку) (2006), основанный на одноименном романе Хироши Огивары;[250] Вдали от нее (2006), на основе Элис Манро с короткий рассказ "Медведь перешел через гору ";[251] Еще Алиса (2014), о Колумбийский университет профессора с ранним началом болезни Альцгеймера, на основании Лиза Генова с Роман 2007 года с таким же названием и показывая Джулианна Мур в главной роли. Документальные фильмы о болезни Альцгеймера включают: Малькольм и Барбара: История любви (1999) и Малькольм и Барбара: Прощание с любовью (2007), оба с участием Малькольм Пойнтон.[252][253][254] Это также изображалось в музыке смотритель в Везде в конце времен.
Направления исследований
Медикамент
В течение десятилетия 2002–2012 гг. 244 соединения были оценены в исследованиях фазы I, фазы II или фазы III, и только одно из них (мемантин ) получила FDA одобрение (хотя другие все еще были в стадии разработки).[255] Соланезумаб и адуканумаб не смог показать эффективность у людей, у которых уже были симптомы Альцгеймера.[256]
Одно из направлений клинических исследований сосредоточено на лечении патологии основного заболевания. Сокращение бета-амилоид уровни - обычная цель соединений[257] (Такие как апоморфин ) под следствием. Иммунотерапия или же вакцинация для амилоидного белка один метод лечения в стадии изучения.[258] В отличие от профилактической вакцинации, предполагаемая терапия будет использоваться для лечения людей, у которых уже установлен диагноз. Он основан на концепции обучения иммунная система для распознавания, атаки и обратного отложения амилоида, тем самым изменяя течение болезни.[259] Примером такой исследуемой вакцины была АСС-001,[260][261] хотя судебные процессы были приостановлены в 2008 году.[262] Другой аналогичный агент - бапинеузумаб, антитело, сконструированное как идентичное естественно индуцированному антиамилоидному антителу.[263] Тем не мение, иммунотерапевтический было обнаружено, что агенты вызывают некоторые опасения побочные реакции на лекарства, Такие как аномалии изображения, связанные с амилоидом.[264] Другие подходы - нейрозащитные агенты, такие как AL-108,[265] и агенты ослабления взаимодействия металл-белок, такие как PBT2.[266] А TNFα блокирование рецепторов гибридный белок, этанерцепт показал обнадеживающие результаты.[267]
В 2008 году два отдельных клинических испытания показали положительные результаты в изменении течения болезни от легкой до умеренной степени БА с метилтиониния хлорид, препарат, подавляющий агрегацию тау,[268][269] и димебон, антигистаминный препарат.[270]Последовательное исследование димебона III фазы не показало положительных эффектов в отношении первичных и вторичных конечных точек.[271][272][273] Работа с хлоридом метилтиониния показала, что на биодоступность метилтиониния из кишечника влияет кормление и кислотность желудка, что приводит к неожиданно изменчивой дозировке.[274] Новый стабилизированный состав, как пролекарство LMTX, проходит III фазу испытаний (в 2014 г.).[275]
В начале 2017 г. вербецестат, что подавляет бета-секретаза белок, ответственный за создание бета-амилоидного белка, был прекращен, так как независимая комиссия обнаружила, что «практически нет шансов найти положительный клинический эффект».[276] В 2018 и 2019 годах будет больше испытаний, в том числе адуканумаб которые снижали концентрацию бета-амилоида, потерпели неудачу, что заставило некоторых усомниться в справедливости гипотезы амилоида.[277][278] Однако в октябре 2019 года анализ другого набора данных показал, что адуканумаб может снизить клиническое снижение у людей с ранней стадией болезни Альцгеймера, и компания Biogen может снова запросить разрешение регулирующих органов.[279]
Мышь с ускоренным старением (SAMP8) представляет собой животную модель болезни Альцгеймера (AD), в которой белок-предшественник амилоида (APP) продуцируется в избыточном количестве. У мышей в раннем возрасте развиваются нарушения памяти и нарушается гематоэнцефалический барьер, что вызывает снижение изгнания белка амилоида-β из мозга. Он вызывает заметное усиление окислительного стресса в головном мозге. Было доказано, что лекарства, снижающие окислительный стресс, улучшают память. Процедуры, снижающие уровень амилоида-β (антисмысловые эффекты по отношению к АРР и антитела к амилоиду-β), не только улучшают память, но и снижают окислительный стресс. Было показано, что начальные отклонения в перекисном повреждении липидов способствуют дисфункции митохондрий как триггеру для избыточной продукции амилоида-β у этой линии мышей AD. Этот процесс приводит к увеличению количества бета-амилоида, который еще больше повреждает митохондрии.[280]
Поведенческая профилактика
Исследования влияния медитации на сохранение памяти и когнитивных функций находятся на начальной стадии.[281] Обзор 2015 года показывает, что внимательность Вмешательства, основанные на вмешательстве, могут предотвратить или отсрочить наступление умеренных когнитивных нарушений и болезни Альцгеймера.[282]
Возможная передача
Редкие случаи возможных коробка передач между людьми изучаются,[283] например к гормон роста пациенты.[284]
Инфекции
В простой герпес вирус HSV-1 был обнаружен в тех же областях, что и амилоидные бляшки.[285] Это предполагает возможность того, что AD можно лечить или предотвращать с помощью противовирусное средство медикамент.[285][286] Исследования противовирусных препаратов в клеточные культуры показали многообещающие результаты.[287]
Описана также грибковая инфекция головного мозга при БА.[288]Эта гипотеза была предложена микробиолог L. Carrasco, когда его группа обнаружила статистическую корреляцию между диссеминированными микозами и БА.[289]Дальнейшая работа показала, что грибковая инфекция присутствует в различных областях мозга пациентов с БА, но не у контрольных лиц.[290][291]Грибковая инфекция объясняет симптомы, наблюдаемые у пациентов с БА. Медленное прогрессирование БА согласуется с хронической природой некоторых системных грибковых инфекций, которые могут протекать бессимптомно и, следовательно, оставаться незамеченными и не лечиться.[290]Гипотезы грибков также совместимы с некоторыми другими установленными гипотезами БА, такими как гипотеза амилоида, которую можно объяснить как реакцию иммунной системы на инфекцию в ЦНС,[292][293][294] как было обнаружено R. Moir и R. Tanzi в моделях AD на мышах и червях.
Изображения
Этот раздел должен быть обновлено. (Апрель 2018 г.) |
Из многих медицинская визуализация доступные методы, однофотонная эмиссионная компьютерная томография (ОФЭКТ), по-видимому, лучше дифференцирует болезнь Альцгеймера от других типов деменции, и было показано, что это дает более высокий уровень точности по сравнению с ментальным тестированием и история болезни анализ.[295] Достижения привели к предложению новых диагностических критериев.[22][122]
PiB ПЭТ остается исследовательским, но аналогичное сканирование ПЭТ радиофармпрепарат называется флорбетапир, содержащий радионуклид длительного действия фтор-18, является диагностическим инструментом при болезни Альцгеймера.[296][297]
Визуализация амилоида, вероятно, будет использоваться в сочетании с другими маркерами, а не в качестве альтернативы.[298] Объемный МРТ может обнаруживать изменения в размере областей мозга. Измерение тех областей, которые атрофируются во время болезни Альцгеймера, является многообещающим диагностическим индикатором. Это может оказаться менее дорогостоящим, чем другие методы визуализации, изучаемые в настоящее время.[299]
В 2011 году комиссия FDA единогласно проголосовала за одобрение флорбетапир.[300] Агент визуализации может помочь обнаружить бляшки в головном мозге Альцгеймера.[301] Отрицательный результат сканирования указывает на редкость или отсутствие бляшек, что не соответствует диагнозу БА.[302]
Диагностика
Акцент в исследованиях болезни Альцгеймера был сделан на диагностике состояния до появления симптомов.[303] Для более раннего обнаружения был разработан ряд биохимических тестов. Некоторые из таких тестов включают анализ спинномозговая жидкость для бета-амилоида, общего белка тау и фосфорилированного тау181P концентрации белка.[304] Поскольку рисование CSF может быть болезненным, следует избегать повторных рисований. Возможным альтернативным индикатором является анализ крови на циркулирующую миРНК и воспалительные биомаркеры.[304]
Серия исследований предполагает, что нарушение гематоэнцефалического барьера, связанное со старением, может быть причиной БА, и приходят к выводу, что маркеры этого повреждения могут быть ранним предиктором заболевания.[305][306][307]
Рекомендации
- ^ а б c d е ж грамм час я j k л м Бернс А., Илифф С. (февраль 2009 г.). "Болезнь Альцгеймера". BMJ. 338: b158. Дои:10.1136 / bmj.b158. PMID 19196745. S2CID 8570146.
- ^ а б c d е ж грамм час "Информационный бюллетень о деменции". Всемирная организация здоровья. 12 декабря 2017.
- ^ а б Мендес М.Ф. (ноябрь 2012 г.). «Болезнь Альцгеймера с ранним началом: неамнестические подтипы и АД 2 типа». Архив медицинских исследований. 43 (8): 677–85. Дои:10.1016 / j.arcmed.2012.11.009. ЧВК 3532551. PMID 23178565.
- ^ а б c d е Баллард С., Готье С., Корбетт А., Брейн С., Арсланд Д., Джонс Э. (март 2011 г.). "Болезнь Альцгеймера". Ланцет. 377 (9770): 1019–31. Дои:10.1016 / S0140-6736 (10) 61349-9. PMID 21371747. S2CID 20893019.
- ^ а б «Диагностика и оценка деменции» (PDF). Национальный институт здравоохранения и передового опыта (NICE). Архивировано из оригинал (PDF) 5 декабря 2014 г.. Получено 30 ноября 2014.
- ^ Комиссия по прозрачности (июнь 2012 г.). «Лекарства от болезни Альцгеймера: лучше избегать. Нет терапевтических преимуществ» [Лекарства от болезни Альцгеймера: лучше избегать. Нет терапевтического преимущества. Prescrire International. 21 (128): 150. PMID 22822592.
- ^ а б Querfurth HW, LaFerla FM (январь 2010 г.). "Болезнь Альцгеймера". Медицинский журнал Новой Англии. 362 (4): 329–44. Дои:10.1056 / NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ а б Соавторы исследования ГББ 2015 г. по распространенности травм, вызванных заболеваниями (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 310 заболеваний и травм, 1990–2015 годы: систематический анализ для исследования глобального бремени болезней 2015». Ланцет. 388 (10053): 1545–1602. Дои:10.1016 / S0140-6736 (16) 31678-6. ЧВК 5055577. PMID 27733282.
- ^ а б ГББ 2015 г. Причины смерти соавторов смерти (октябрь 2016 г.). «Ожидаемая продолжительность жизни на глобальном, региональном и национальном уровнях, смертность от всех причин и смертность от конкретных причин для 249 причин смерти, 1980–2015 годы: систематический анализ для исследования глобального бремени болезней 2015 года». Ланцет. 388 (10053): 1459–1544. Дои:10.1016 / S0140-6736 (16) 31012-1. ЧВК 5388903. PMID 27733281.
- ^ «О болезни Альцгеймера: симптомы». Национальный институт старения. Архивировано из оригинал 15 января 2012 г.. Получено 28 декабря 2011.
- ^ Тодд С., Барр С., Робертс М., Пассмор А. П. (ноябрь 2013 г.). «Выживаемость при деменции и предикторы смертности: обзор». Международный журнал гериатрической психиатрии. 28 (11): 1109–24. Дои:10.1002 / гпс.3946. PMID 23526458. S2CID 25445595.
- ^ "Так что ты можешь сделать?". Национальный институт старения. 29 июля 2016 г. Архивировано с оригинал 3 апреля 2017 г.
- ^ а б c d е Сюй Д., Маршалл Г.А. (2017). «Испытания первичной и вторичной профилактики болезни Альцгеймера: взгляд назад, движение вперед». Текущее исследование болезни Альцгеймера. 14 (4): 426–40. Дои:10.2174/1567205013666160930112125. ЧВК 5329133. PMID 27697063.
- ^ а б c d Томпсон, Калифорния, Спилсбери К., Холл Дж., Биркс Ю., Барнс К., Адамсон Дж. (Июль 2007 г.). «Систематический обзор информации и вспомогательных мероприятий для лиц, осуществляющих уход за людьми с деменцией». BMC Гериатрия. 7: 18. Дои:10.1186/1471-2318-7-18. ЧВК 1951962. PMID 17662119.
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (апрель 2015 г.). «Программы упражнений для людей с деменцией». Кокрановская база данных систематических обзоров (Представлена рукопись). 132 (4): CD006489. Дои:10.1002 / 14651858.CD006489.pub4. PMID 25874613.
- ^ Национальный институт здоровья и клинического совершенства. «Низкие дозы нейролептиков у людей с деменцией». Национальный институт здравоохранения и передового опыта (NICE). Архивировано из оригинал 5 декабря 2014 г.. Получено 29 ноябрь 2014.
- ^ «Информация для медицинских работников: традиционные антипсихотические препараты». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 16 июня 2008 г. Архивировано с оригинал 29 ноября 2014 г.. Получено 29 ноябрь 2014.
- ^ а б c Берхтольд NC, Котман CW (1998). «Эволюция концептуального представления о деменции и болезни Альцгеймера: греко-римский период до 1960-х годов». Нейробиология старения. 19 (3): 173–89. Дои:10.1016 / S0197-4580 (98) 00052-9. PMID 9661992. S2CID 24808582.
- ^ а б c d Бонин-Гийом С, Зекри Д., Джакобини Э, Голд Г, Мишель Дж. П. (январь 2005 г.). «[Экономические последствия деменции]». Presse Médicale (На французском). 34 (1): 35–41. Дои:10.1016 / s0755-4982 (05) 83882-5. PMID 15685097.
- ^ а б c d е Кроткий П. Д., МакКейтан К., Шумок Г. Т. (1998). «Экономические соображения при болезни Альцгеймера». Фармакотерапия. 18 (2 Pt 2): 68–73, обсуждение 79–82. Дои:10.1002 / j.1875-9114.1998.tb03880.x (неактивно 11 ноября 2020 г.). PMID 9543467.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ «Оценка лекарств, отпускаемых по рецепту, используемых для лечения: болезнь Альцгеймера, сравнивая эффективность, безопасность и цену» (PDF). Потребительские отчеты Проект обзора эффективности лекарств. Потребительские отчеты. Май 2012. Архивировано с оригинал (PDF) 5 сентября 2012 г.. Получено 1 мая 2013.
- ^ а б c d е Вальдемар Дж., Дюбуа Б., Эмре М., Жорж Дж., МакКейт И.Г., Россор М., Шелтенс П., Тариска П., Винблад Б. (январь 2007 г.). «Рекомендации по диагностике и лечению болезни Альцгеймера и других расстройств, связанных с деменцией: руководство EFNS». Европейский журнал неврологии. 14 (1): e1–26. Дои:10.1111 / j.1468-1331.2006.01605.x. PMID 17222085. S2CID 2725064.
- ^ а б c Бэкман Л., Джонс С., Бергер А. К., Лаукка Э. Дж., Смолл Б. Дж. (Сентябрь 2004 г.). «Множественные когнитивные нарушения при переходе к болезни Альцгеймера». Журнал внутренней медицины. 256 (3): 195–204. Дои:10.1111 / j.1365-2796.2004.01386.x. PMID 15324363. S2CID 37005854.
- ^ Нюгард Л. (2003). «Инструментальная деятельность в повседневной жизни: ступенька к диагностике болезни Альцгеймера у субъектов с легкими когнитивными нарушениями?». Acta Neurologica Scandinavica. Дополнение. 179 (s179): 42–6. Дои:10.1034 / j.1600-0404.107.s179.8.x. PMID 12603250. S2CID 25313065.
- ^ а б Арнаис Э., Альмквист О (2003). «Нейропсихологические особенности легких когнитивных нарушений и доклинической болезни Альцгеймера». Acta Neurologica Scandinavica. Дополнение. 179: 34–41. Дои:10.1034 / j.1600-0404.107.s179.7.x. PMID 12603249. S2CID 22494768.
- ^ Дирдорф WJ, Гроссберг GT (2019). «Поведенческие и психологические симптомы при деменции Альцгеймера и сосудистой деменции». Справочник по клинической неврологии. 165: 5–32. Дои:10.1016 / B978-0-444-64012-3.00002-2. ISBN 9780444640123. PMID 31727229.
- ^ Мюррей ЭД, Баттнер Н., Прайс Б.Н. (2012). «Депрессия и психоз в неврологической практике». В Bradley WG, Daroff RB, Fenichel GM, Jankovic J (ред.). Неврология Брэдли в клинической практике (6-е изд.). Филадельфия, Пенсильвания: Эльзевьер / Сондерс. ISBN 978-1-4377-0434-1.
- ^ Грундман М., Петерсен Р.К., Феррис С.Х. и др. (Январь 2004 г.). «Легкие когнитивные нарушения можно отличить от болезни Альцгеймера и нормального старения для клинических испытаний». Архив неврологии. 61 (1): 59–66. Дои:10.1001 / archneur.61.1.59. PMID 14732621.
- ^ а б c d е ж грамм час я j k л м п о п q р s Förstl H, Kurz A (1999). «Клинические особенности болезни Альцгеймера». Европейский архив психиатрии и клинической неврологии. 249 (6): 288–90. Дои:10.1007 / s004060050101. PMID 10653284. S2CID 26142779.
- ^ Карлезимо Г.А., Оскар-Берман М. (июнь 1992 г.). «Нарушения памяти у пациентов с болезнью Альцгеймера: всесторонний обзор». Обзор нейропсихологии. 3 (2): 119–69. Дои:10.1007 / BF01108841. PMID 1300219. S2CID 19548915.
- ^ Еличич М., Бонебаккер А.Е., Бонке Б. (1995). «Неявная производительность памяти пациентов с болезнью Альцгеймера: краткий обзор». Международная психогериатрия. 7 (3): 385–92. Дои:10.1017 / S1041610295002134. PMID 8821346.
- ^ а б Талер В., Филлипс Н.А. (июль 2008 г.). «Речевые способности при болезни Альцгеймера и умеренных когнитивных нарушениях: сравнительный обзор». Журнал клинической и экспериментальной нейропсихологии. 30 (5): 501–56. Дои:10.1080/13803390701550128. PMID 18569251. S2CID 37153159.
- ^ а б c Франк Э.М. (сентябрь 1994 г.). «Влияние болезни Альцгеймера на коммуникативную функцию». Журнал Медицинской ассоциации Южной Каролины. 90 (9): 417–23. PMID 7967534.
- ^ Воличер Л., Харпер Д.Г., Мэннинг BC, Голдштейн Р., Сатлин А. (май 2001 г.). «Закат и циркадные ритмы при болезни Альцгеймера». Американский журнал психиатрии. 158 (5): 704–11. Дои:10.1176 / appi.ajp.158.5.704. PMID 11329390. S2CID 10492607.
- ^ Золотой Д.П., Рейс М.Ф., Маркевич Д., Андрес Д. (январь 1995 г.). «Когда уход на дому заканчивается: продольное исследование результатов для лиц, ухаживающих за родственниками с деменцией». Журнал Американского гериатрического общества. 43 (1): 10–6. Дои:10.1111 / j.1532-5415.1995.tb06235.x. PMID 7806732. S2CID 29847950.
- ^ Болезнь Альцгеймера - Причины (NHS)
- ^ «Что мы знаем сегодня о болезни Альцгеймера». Ассоциация Альцгеймера. Архивировано из оригинал 7 октября 2011 г.. Получено 1 октября 2011.
Хотя ученые знают, что болезнь Альцгеймера связана с прогрессирующей недостаточностью клеток головного мозга, причина отказа не ясна.
- ^ Reitz C, Mayeux R (апрель 2014 г.). «Болезнь Альцгеймера: эпидемиология, диагностические критерии, факторы риска и биомаркеры». Биохимическая фармакология. 88 (4): 640–51. Дои:10.1016 / j.bcp.2013.12.024. ЧВК 3992261. PMID 24398425.
- ^ Wilson RS, Barral S, Lee JH, Leurgans SE, Foroud TM, Sweet RA, Graff-Radford N, Bird TD, Mayeux R, Bennett DA (2011). "Наследственность различных форм памяти в семейном исследовании позднего начала болезни Альцгеймера". Журнал болезни Альцгеймера. 23 (2): 249–55. Дои:10.3233 / JAD-2010-101515. ЧВК 3130303. PMID 20930268.
- ^ а б c Blennow K, de Leon MJ, Zetterberg H (июль 2006 г.). "Болезнь Альцгеймера". Ланцет. 368 (9533): 387–403. Дои:10.1016 / S0140-6736 (06) 69113-7. PMID 16876668. S2CID 47544338.
- ^ а б Waring SC, Розенберг RN (март 2008 г.). «Полногеномные исследования ассоциации при болезни Альцгеймера». Архив неврологии. 65 (3): 329–34. Дои:10.1001 / archneur.65.3.329. PMID 18332245.
- ^ Selkoe DJ (июнь 1999 г.). «Перевод клеточной биологии в терапевтические достижения при болезни Альцгеймера». Природа. 399 (6738 Прил.): A23–31. Дои:10.1038/19866. PMID 10392577. S2CID 42287088.
- ^ Borchelt DR, Thinakaran G, Eckman CB и др. (Ноябрь 1996 г.). «Семейные варианты пресенилина 1, связанные с болезнью Альцгеймера, повышают соотношение Abeta1-42 / 1-40 in vitro и in vivo». Нейрон. 17 (5): 1005–13. Дои:10.1016 / S0896-6273 (00) 80230-5. PMID 8938131. S2CID 18315650.
- ^ Ким, JH (декабрь 2018 г.). «Генетика болезни Альцгеймера». Деменция и нейрокогнитивные расстройства. 17 (4): 131–36. Дои:10.12779 / dnd.2018.17.4.131. ЧВК 6425887. PMID 30906402.
- ^ Strittmatter WJ, Saunders AM, Schmechel D, Pericak-Vance M, Enghild J, Salvesen GS, Roses AD (март 1993 г.). «Аполипопротеин E: высокая авидность связывания с бета-амилоидом и повышенная частота аллеля типа 4 при семейной болезни Альцгеймера с поздним началом». Труды Национальной академии наук Соединенных Штатов Америки. 90 (5): 1977–81. Bibcode:1993ПНАС ... 90.1977С. Дои:10.1073 / пнас.90.5.1977. ЧВК 46003. PMID 8446617.
- ^ а б Mahley RW, Weisgraber KH, Huang Y (апрель 2006 г.). «Аполипопротеин E4: причинный фактор и терапевтическая мишень при невропатологии, включая болезнь Альцгеймера». Труды Национальной академии наук Соединенных Штатов Америки. 103 (15): 5644–51. Bibcode:2006ПНАС..103.5644М. Дои:10.1073 / pnas.0600549103. ЧВК 1414631. PMID 16567625.
- ^ Холл К., Мюррелл Дж., Огуннийи А., Диг М., Байеву О, Гао С., Гуредже О, Диккенс Дж., Эванс Р., Смит-Гэмбл В., Унверзагт Ф. В., Шен Дж., Хендри Х (январь 2006 г.). «Холестерин, генотип APOE и болезнь Альцгеймера: эпидемиологическое исследование нигерийского йоруба». Неврология. 66 (2): 223–27. Дои:10.1212 / 01.wnl.0000194507.39504.17. ЧВК 2860622. PMID 16434658.
- ^ Гуредже О, Огунний А., Байеву О и др. (Январь 2006 г.). «APOE epsilon4 не связан с болезнью Альцгеймера у пожилых нигерийцев». Анналы неврологии. 59 (1): 182–85. Дои:10.1002 / ana.20694. ЧВК 2855121. PMID 16278853.
- ^ а б Lambert JC, Ibrahim-Verbaas CA, Harold D, et al. (Декабрь 2013). «Мета-анализ 74046 человек выявил 11 новых локусов восприимчивости к болезни Альцгеймера». Природа Генетика. 45 (12): 1452–58. Дои:10,1038 / нг.2802. ЧВК 3896259. PMID 24162737.
- ^ Йонссон Т., Стефанссон Х., Стейнберг С. и др. (Январь 2013). «Вариант TREM2, связанный с риском болезни Альцгеймера». Медицинский журнал Новой Англии (Оригинальная статья). 368 (2): 107–16. Дои:10.1056 / NEJMoa1211103. ЧВК 3677583. PMID 23150908.
- ^ Геррейро Р., Войтас А., Бра Дж. И др. (Январь 2013). «Варианты TREM2 при болезни Альцгеймера». Медицинский журнал Новой Англии (Оригинальная статья). 368 (2): 117–27. Дои:10.1056 / NEJMoa1211851. ЧВК 3631573. PMID 23150934.
- ^ Мукерджи С., Мез Дж., Тритчух Э. Х., Сайкин А. Дж., Гиббонс Л. Э., Фардо Д. В., Весселс М., Бауман Дж., Мур М., Чой С. Е., Гросс А. Л., Рич Дж., Лауден Д. К., Сандерс Р. Э., Грабовски Т. Дж., Берд Т. Д. и др. . (Декабрь 2018 г.). «Генетические данные и когнитивно определенные подгруппы болезни Альцгеймера с поздним началом». Молекулярная психиатрия. 25 (11): 2942–2951. Дои:10.1038 / с41380-018-0298-8. ЧВК 6548676. PMID 30514930.
- ^ Фрэнсис П. Т., Палмер А. М., Снейп М., Уилкок Г. К. (февраль 1999 г.). «Холинергическая гипотеза болезни Альцгеймера: обзор прогресса». Журнал неврологии, нейрохирургии и психиатрии. 66 (2): 137–47. Дои:10.1136 / jnnp.66.2.137. ЧВК 1736202. PMID 10071091.
- ^ Марторана А., Эспозито З, Кох Г. (август 2010 г.). «Помимо холинергической гипотезы: работают ли современные лекарства при болезни Альцгеймера?». ЦНС нейробиология и терапия. 16 (4): 235–45. Дои:10.1111 / j.1755-5949.2010.00175.x. ЧВК 6493875. PMID 20560995.
- ^ Харди Дж., Оллсоп Д. (октябрь 1991 г.). «Отложение амилоида как центральное событие в этиологии болезни Альцгеймера». Тенденции в фармакологических науках. 12 (10): 383–88. Дои:10.1016 / 0165-6147 (91) 90609-В. PMID 1763432.
- ^ а б Mudher A, Lovestone S (январь 2002 г.). «Болезнь Альцгеймера - разве тауисты и баптисты наконец-то пожмут друг другу руки?». Тенденции в неврологии. 25 (1): 22–26. Дои:10.1016 / S0166-2236 (00) 02031-2. PMID 11801334. S2CID 37380445.
- ^ Нистор М., Дон М., Парех М., Сарсоза Ф., Гудус М., Лопес Г.Э., Кавас С., Леверенц Дж., Доран Э., Лотт ИТ, Хилл М., Хед Е (октябрь 2007 г.). «Активность альфа- и бета-секретаз в зависимости от возраста и бета-амилоида при синдроме Дауна и нормальном мозге». Нейробиология старения. 28 (10): 1493–506. Дои:10.1016 / j.neurobiolaging.2006.06.023. ЧВК 3375834. PMID 16904243.
- ^ Lott IT, глава E (март 2005 г.). «Болезнь Альцгеймера и синдром Дауна: факторы патогенеза». Нейробиология старения. 26 (3): 383–89. Дои:10.1016 / j.neurobiolaging.2004.08.005. PMID 15639317. S2CID 27716613.
- ^ Полвикоски Т., Сулкава Р., Халтиа М., Кайнулайнен К., Вуорио А., Верккониеми А., Ниинистё Л., Халонен П., Контула К. (ноябрь 1995 г.). «Аполипопротеин E, деменция и кортикальное отложение бета-амилоидного белка». Медицинский журнал Новой Англии. 333 (19): 1242–47. Дои:10.1056 / NEJM199511093331902. PMID 7566000.
- ^ Трансгенные мыши:
- Игры D, Адамс Д., Алессандрини Р., Барбур Р., Бертелетт П., Блэквелл С., Карр Т., Клеменс Дж., Дональдсон Т., Гиллеспи Ф. (февраль 1995 г.). «Невропатология типа Альцгеймера у трансгенных мышей, сверхэкспрессирующих белок-предшественник бета-амилоида V717F». Природа. 373 (6514): 523–27. Bibcode:1995Натура.373..523G. Дои:10.1038 / 373523a0. PMID 7845465. S2CID 4255816.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (сентябрь 1996 г.). «Сравнение нейродегенеративной патологии у трансгенных мышей, сверхэкспрессирующих белок-предшественник бета-амилоида V717F, и болезнь Альцгеймера». Журнал неврологии. 16 (18): 5795–811. Дои:10.1523 / JNEUROSCI.16-18-05795.1996. ЧВК 6578961. PMID 8795633.
- Сяо К., Чепмен П., Нильсен С., Экман К., Харигая Ю., Юнкин С., Ян Ф., Коул Г. (октябрь 1996 г.). «Корреляционная недостаточность памяти, повышение уровня Abeta и амилоидные бляшки у трансгенных мышей». Наука. 274 (5284): 99–102. Bibcode:1996Наука ... 274 ... 99H. Дои:10.1126 / наука.274.5284.99. PMID 8810256. S2CID 32419070.
- Lalonde R, Dumont M, Staufenbiel M, Sturchler-Pierrat C, Strazielle C (ноябрь 2002 г.). «Пространственное обучение, исследование, беспокойство и координация движений у самок трансгенных мышей APP23 с мутацией Swedish». Исследование мозга. 956 (1): 36–44. Дои:10.1016 / S0006-8993 (02) 03476-5. PMID 12426044. S2CID 10083365.
- ^ Холмс С., Бош Д., Уилкинсон Д., Ядегарфар Г., Хопкинс В., Байер А., Джонс Р. В., Буллок Р., Лав С., Нил Дж. В., Зотова Е., Николл Дж. А. (июль 2008 г.). «Долгосрочные эффекты иммунизации Abeta42 при болезни Альцгеймера: наблюдение за рандомизированным плацебо-контролируемым испытанием фазы I». Ланцет. 372 (9634): 216–23. Дои:10.1016 / S0140-6736 (08) 61075-2. PMID 18640458. S2CID 18340153.
- ^ Lacor PN, Buniel MC, Furlow PW и др. (Январь 2007 г.). «Вызванные олигомером Abeta аберрации в составе, форме и плотности синапсов обеспечивают молекулярную основу для потери связности при болезни Альцгеймера». Журнал неврологии. 27 (4): 796–807. Дои:10.1523 / JNEUROSCI.3501-06.2007. ЧВК 6672917. PMID 17251419.
- ^ Лорен Дж., Гимбель Д.А., Найгаард Х. Б., Гилберт Дж. В., Strittmatter SM (февраль 2009 г.). «Клеточный прионный белок опосредует нарушение синаптической пластичности олигомерами бета-амилоида». Природа. 457 (7233): 1128–32. Bibcode:2009 Натур.457.1128Л. Дои:10.1038 / природа07761. ЧВК 2748841. PMID 19242475.
- ^ а б Николаев А., Маклафлин Т., О'Лири Д.Д., Тесье-Лавин М. (февраль 2009 г.). «APP связывает DR6, чтобы вызвать отсечение аксонов и гибель нейронов через отдельные каспазы». Природа. 457 (7232): 981–89. Bibcode:2009Натура.457..981Н. Дои:10.1038 / природа07767. ЧВК 2677572. PMID 19225519.
- ^ Томияма Т. (2010). «Участие бета-амилоида в этиологии болезни Альцгеймера». Мозговой нерв. 62 (7): 691–699. PMID 20675873.
- ^ Томияма Т, Нагата Т, Шимада Х, Тераока Р, Фукусима А, Канемицу Х, Такума Х, Кувано Р, Имагава М, Атака С, Вада Й, Йошиока Э, Нишизаки Т, Ватанабэ Й, Мори Х (2008). «Новый вариант бета-амилоида, благоприятствующий олигомеризации при деменции типа Альцгеймера». Энн Нейрол. 63 (3): 377–387. Дои:10.1002 / ana.21321. PMID 18300294. S2CID 42311988.CS1 maint: несколько имен: список авторов (связь)
- ^ Goedert M, Spillantini MG, Crowther RA (июль 1991 г.). «Тау-белки и нейрофибриллярная дегенерация». Патология головного мозга. 1 (4): 279–86. Дои:10.1111 / j.1750-3639.1991.tb00671.x. PMID 1669718. S2CID 33331924.
- ^ Икбал К., Алонсо А., Чен С., Чохан М.О., Эль-Аккад Э, Гонг С.Х., Хатун С., Ли Б., Лю Ф., Рахман А., Танимукай Х., Грундке-Икбал I (январь 2005 г.). «Тау-патология при болезни Альцгеймера и других таупатиях». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1739 (2–3): 198–210. Дои:10.1016 / j.bbadis.2004.09.008. PMID 15615638.
- ^ Чун В., Джонсон Г. В. (январь 2007 г.). «Роль фосфорилирования и расщепления тау в гибели нейрональных клеток». Границы биологических наук. 12: 733–56. Дои:10.2741/2097. PMID 17127334. S2CID 40048768.
- ^ а б Камер А.Р., Крейг Р.Г., Дасанаяке А.П., Брис М., Глодзик-Собанска Л., де Леон М.Дж. (июль 2008 г.). «Воспаление и болезнь Альцгеймера: возможная роль заболеваний пародонта». Болезнь Альцгеймера и деменция. 4 (4): 242–50. Дои:10.1016 / j.jalz.2007.08.004. PMID 18631974. S2CID 8633979.
- ^ Коллинз С.М., Сюретт М., Берчик П. (ноябрь 2012 г.). «Взаимодействие между кишечной микробиотой и мозгом». Обзоры природы. Микробиология. 10 (11): 735–42. Дои:10.1038 / nrmicro2876. PMID 23000955. S2CID 36411264.
- ^ Дин Р., Злокович Б.В. (апрель 2007 г.). «Роль гематоэнцефалического барьера в патогенезе болезни Альцгеймера». Текущее исследование болезни Альцгеймера. 4 (2): 191–97. Дои:10.2174/156720507780362245. PMID 17430246.
- ^ Миклосси Дж (август 2011 г.). «Болезнь Альцгеймера - нейроспирохетоз. Анализ данных по критериям Коха и Хилла». Журнал нейровоспаления. 8 (1): 90. Дои:10.1186/1742-2094-8-90. ЧВК 3171359. PMID 21816039.
- ^ Аллен, HB (27 июня 2016 г.). «Болезнь Альцгеймера: оценка роли спирохет, биопленок, иммунной системы и амилоида-β в отношении потенциального лечения и профилактики». Журнал болезни Альцгеймера. 53 (4): 1271–76. Дои:10.3233 / JAD-160388. ЧВК 5008232. PMID 27372648.
- ^ Сюй Х., Финкельштейн Д.И., Адлард П.А. (12 июня 2014 г.). «Взаимодействие металлов и аполипопротеина Е при болезни Альцгеймера». Границы старения нейронауки. 6: 121. Дои:10.3389 / fnagi.2014.00121. ЧВК 4054654. PMID 24971061.
Хотя мы до сих пор не знаем, является ли дисомеостаз ионов металлов, присутствующий при БА, причиной или следствием заболевания, появляется все больше данных, показывающих прямую корреляцию между ионами металлов и ключевыми белками, связанными с БА.
- ^ Су Б, Ван Х, Нуномура А., Морейра П.И., Ли Х.Г., Перри Дж., Смит М.А., Чжу Х (декабрь 2008 г.). «Сигнализация окислительного стресса при болезни Альцгеймера». Текущее исследование болезни Альцгеймера. 5 (6): 525–32. Дои:10.2174/156720508786898451. ЧВК 2780015. PMID 19075578.
- ^ Кастенхольц Б., Гарфин Д.Е., Хорст Дж., Нагель К.А. (2009). «Шапероны из растительных металлов: новая перспектива в терапии деменции». Амилоид. 16 (2): 81–83. Дои:10.1080/13506120902879392. PMID 20536399. S2CID 37490474.
- ^ «Алюминий и болезнь Альцгеймера». Факты о деменции. Общество Альцгеймера. Архивировано из оригинал 27 октября 2005 г.. Получено 14 октября 2005.
- ^ Бонди СК (январь 2016 г.). «Низкий уровень алюминия может привести к поведенческим и морфологическим изменениям, связанным с болезнью Альцгеймера и возрастной нейродегенерацией». Нейротоксикология (Представлена рукопись). 52: 222–29. Дои:10.1016 / j.neuro.2015.12.002. PMID 26687397.
- ^ Kandimalla R, Vallamkondu J, Corgiat EB, Gill KD (март 2016 г.). «Понимание аспектов воздействия алюминия при развитии болезни Альцгеймера». Патология головного мозга. 26 (2): 139–54. Дои:10.1111 / bpa.12333. PMID 26494454. S2CID 40859643.
- ^ Сантибаньес М., Болумар Ф., Гарсия А.М. (ноябрь 2007 г.). «Факторы профессионального риска при болезни Альцгеймера: обзор, оценивающий качество опубликованных эпидемиологических исследований». Медицина труда и окружающей среды. 64 (11): 723–32. Дои:10.1136 / oem.2006.028209. ЧВК 2078415. PMID 17525096.
- ^ а б Лидский Т.И. (май 2014 г.). "Алюминиевая гипотеза мертва?". Журнал профессиональной и экологической медицины. 56 (5 Прил.): S73–79. Дои:10.1097 / jom.0000000000000063. ЧВК 4131942. PMID 24806729.
- ^ Егамбарам М, Маниваннан Б, Бич Т.Г., Халден РУ (2015). «Роль загрязнителей окружающей среды в этиологии болезни Альцгеймера: обзор». Текущее исследование болезни Альцгеймера. 12 (2): 116–46. Дои:10.2174/1567205012666150204121719. ЧВК 4428475. PMID 25654508.
- ^ Катальдо Дж. К., Прочаска Дж. Дж., Гланц С. А. (2010). «Курение сигарет - фактор риска болезни Альцгеймера: анализ, учитывающий принадлежность табачной промышленности». Журнал болезни Альцгеймера. 19 (2): 465–80. Дои:10.3233 / JAD-2010-1240. ЧВК 2906761. PMID 20110594.
- ^ Eikelenboom P, van Exel E, Hoozemans JJ, Veerhuis R, Rozemuller AJ, van Gool WA (2010). «Нейровоспаление - раннее событие как в истории, так и в патогенезе болезни Альцгеймера». Нейродегенеративные заболевания. 7 (1–3): 38–41. Дои:10.1159/000283480. PMID 20160456. S2CID 40048333.
- ^ Моултон П.В., Ян В. (2012). «Загрязнение воздуха, окислительный стресс и болезнь Альцгеймера». Журнал окружающей среды и общественного здоровья (Рассмотрение). 2012: 1–9. Дои:10.1155/2012/472751. ЧВК 3317180. PMID 22523504.
- ^ Барцокис Г (август 2011). «Болезнь Альцгеймера как гомеостатический ответ на возрастной распад миелина». Нейробиология старения. 32 (8): 1341–71. Дои:10.1016 / j.neurobiolaging.2009.08.007. ЧВК 3128664. PMID 19775776.
- ^ Цай З, Сяо М. (2016). «Олигодендроциты и болезнь Альцгеймера». Международный журнал неврологии. 126 (2): 97–104. Дои:10.3109/00207454.2015.1025778. PMID 26000818. S2CID 21448714.
- ^ а б c Райсберг Б., Франссен Э. Х., Хасан С. М. и др. (1999). «Ретрогенез: клинические, физиологические и патологические механизмы старения мозга, болезни Альцгеймера и других дементирующих процессов». Европейский архив психиатрии и клинической неврологии. 249 Suppl 3 (3): 28–36. Дои:10.1007 / pl00014170. PMID 10654097. S2CID 23410069.
- ^ Алвес Г.С., Эртель Кнёхель В., Кнёхель С., Карвалью А.Ф., Пантель Дж., Энгельхардт Е., Лакс Дж. (2015). «Интеграция теории ретрогенеза с патологией болезни Альцгеймера: выводы из исследования микроструктурной целостности белого вещества, проведенного DTI-TBSS». BioMed Research International. 2015: 291658. Дои:10.1155/2015/291658. ЧВК 4320890. PMID 25685779.
- ^ Бреннер Карсон, Верна (2015). Уход за болезнью Альцгеймера. Нью-Йорк: Springer New York Academy of Sciences. С. 1–9. ISBN 978-1-4939-2406-6.
- ^ Зис П., Хадживассилёв М. (февраль 2019). «Лечение неврологических проявлений чувствительности к глютену и целиакии». Современные варианты лечения в неврологии. 21 (3): 10. Дои:10.1007 / s11940-019-0552-7. PMID 30806821. S2CID 73466457.
- ^ Махлуф С., Мессельмани М., Зауали Дж., Мрисса Р. (март 2018 г.). «Когнитивные нарушения при глютеновой болезни и не глютеновой чувствительности: обзор литературы по основным когнитивным нарушениям, визуализации и влиянию безглютеновой диеты». Acta Neurologica Belgica (Рассмотрение). 118 (1): 21–27. Дои:10.1007 / s13760-017-0870-z. PMID 29247390. S2CID 3943047.
- ^ Венк Г.Л. (2003). «Невропатологические изменения при болезни Альцгеймера». Журнал клинической психиатрии. 64 Дополнение 9: 7–10. PMID 12934968.
- ^ Браак Х., Дель Тредичи К. (декабрь 2012 г.). «Где, когда и в какой форме начинается спорадическая болезнь Альцгеймера?». Текущее мнение в неврологии. 25 (6): 708–14. Дои:10.1097 / WCO.0b013e32835a3432. PMID 23160422.
- ^ Desikan RS, Cabral HJ, Hess CP, Dillon WP, Glastonbury CM, Weiner MW, Schmansky NJ, Greve DN, Salat DH, Buckner RL, Fischl B (август 2009 г.). «Автоматизированные методы МРТ позволяют выявлять людей с умеренными когнитивными нарушениями и болезнью Альцгеймера». Мозг. 132 (Pt 8): 2048–57. Дои:10.1093 / мозг / awp123. ЧВК 2714061. PMID 19460794.
- ^ Moan R (20 июля 2009 г.). «Программное обеспечение МРТ точно идентифицирует доклиническую болезнь Альцгеймера». Диагностическая визуализация. Архивировано из оригинал 16 мая 2016 г.. Получено 7 января 2013.
- ^ а б Тирабоски П., Хансен Л.А., Тал Л.Дж., Кори-Блум Дж. (Июнь 2004 г.). «Важность нейритных бляшек и клубков для развития и эволюции AD». Неврология. 62 (11): 1984–89. Дои:10.1212 / 01.WNL.0000129697.01779.0A. PMID 15184601. S2CID 25017332.
- ^ DeTure, Michael A .; Диксон, Деннис В. (2019). «Невропатологический диагноз болезни Альцгеймера». Молекулярная нейродегенерация. 14 (1): 32. Дои:10.1186 / s13024-019-0333-5. ISSN 1750-1326. ЧВК 6679484. PMID 31375134.
- ^ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). «Региональное распределение нейрофибриллярных клубков и сенильных бляшек в коре головного мозга пожилых пациентов: количественная оценка однолетнего аутопсии из гериатрической больницы» (PDF). Кора головного мозга. 4 (2): 138–50. Дои:10.1093 / cercor / 4.2.138. PMID 8038565.
- ^ Kotzbauer PT, Trojanowsk JQ, Lee VM (октябрь 2001 г.). «Патология тельца Леви при болезни Альцгеймера». Журнал молекулярной неврологии. 17 (2): 225–32. Дои:10.1385 / JMN: 17: 2: 225. PMID 11816795. S2CID 44407971.
- ^ Хашимото М., Рокенштейн Э, Экипаж Л., Маслия Э (2003). «Роль агрегации белков в митохондриальной дисфункции и нейродегенерации при болезнях Альцгеймера и Паркинсона». Нейромолекулярная медицина. 4 (1–2): 21–36. Дои:10.1385 / НММ: 4: 1-2: 21. PMID 14528050. S2CID 20760249.
- ^ Приллер С., Бауэр Т., Миттереггер Г., Кребс Б., Кречмар Х.А., Хермс Дж. (Июль 2006 г.). «Формирование и функция синапсов регулируется белком-предшественником амилоида». Журнал неврологии. 26 (27): 7212–21. Дои:10.1523 / JNEUROSCI.1450-06.2006. ЧВК 6673945. PMID 16822978.
- ^ Тернер PR, О'Коннор К., Тейт WP, Абрахам WC (май 2003 г.). «Роли белка-предшественника амилоида и его фрагментов в регуляции нервной активности, пластичности и памяти». Прогресс в нейробиологии. 70 (1): 1–32. Дои:10.1016 / S0301-0082 (03) 00089-3. PMID 12927332. S2CID 25376584.
- ^ Хупер Н.М. (апрель 2005 г.). «Роль протеолиза и липидных рафтов в процессинге белка-предшественника амилоида и прионного белка». Сделки биохимического общества. 33 (Pt 2): 335–38. Дои:10.1042 / BST0330335. PMID 15787600. S2CID 14269634.
- ^ Охниши С., Такано К. (март 2004 г.). «Амилоидные фибриллы с точки зрения сворачивания белков». Клеточные и молекулярные науки о жизни. 61 (5): 511–24. Дои:10.1007 / s00018-003-3264-8. PMID 15004691. S2CID 25739126.
- ^ Эрнандес Ф, Авила Дж (сентябрь 2007 г.). «Таупатии». Клеточные и молекулярные науки о жизни. 64 (17): 2219–33. Дои:10.1007 / s00018-007-7220-х. PMID 17604998.
- ^ Sun W, Samimi H, Gamez M, Zare H, Frost B (август 2018). «Патогенное тау-индуцированное истощение пиРНК способствует гибели нейронов из-за нарушения регуляции подвижных элементов при нейродегенеративных таупатиях». Природа Неврология. 21 (8): 1038–48. Дои:10.1038 / s41593-018-0194-1. ЧВК 6095477. PMID 30038280.
- ^ Ван Брок Б., Ван Брокховен С., Кумар-Сингх С. (2007). «Текущее понимание молекулярных механизмов болезни Альцгеймера и их значения для терапевтических подходов». Нейродегенеративные заболевания. 4 (5): 349–65. Дои:10.1159/000105156. PMID 17622778. S2CID 7949658.
- ^ Хуанг Y, Mucke L (март 2012 г.). «Механизмы болезни Альцгеймера и терапевтические стратегии». Клетка. 148 (6): 1204–22. Дои:10.1016 / j.cell.2012.02.040. ЧВК 3319071. PMID 22424230.
- ^ Янкнер Б.А., Даффи Л.К., Киршнер Д.А. (октябрь 1990 г.). «Нейротрофические и нейротоксические эффекты бета-амилоидного белка: обращение нейропептидов тахикинина». Наука. 250 (4978): 279–82. Bibcode:1990Sci ... 250..279Y. Дои:10.1126 / science.2218531. PMID 2218531.
- ^ Чен X, Ян С.Д. (декабрь 2006 г.). «Митохондриальная Abeta: потенциальная причина метаболической дисфункции при болезни Альцгеймера». IUBMB Life. 58 (12): 686–94. Дои:10.1080/15216540601047767. PMID 17424907. S2CID 85423830.
- ^ Грейг Н.Х., Маттсон М.П., Перри Т., Чан С.Л., Джордано Т., Самбамурти К., Роджерс Д.Т., Овадия Х., Лахири Д.К. (декабрь 2004 г.). «Новые терапевтические стратегии и лекарственные препараты-кандидаты от нейродегенеративных заболеваний: ингибиторы р53 и TNF-альфа, а также агонисты рецепторов GLP-1». Летопись Нью-Йоркской академии наук. 1035: 290–315. Дои:10.1196 / летопись.1332.018. PMID 15681814. S2CID 84659695.
- ^ Хенека М.Т., Карсон М.Дж., Эль-Хури Дж. И др. (Апрель 2015 г.). «Нейровоспаление при болезни Альцгеймера». Ланцет. Неврология. 14 (4): 388–405. Дои:10.1016 / S1474-4422 (15) 70016-5. ЧВК 5909703. PMID 25792098.
- ^ Tapia-Arancibia L, Aliaga E, Silhol M, Arancibia S (ноябрь 2008 г.). «Новые сведения о функции мозга BDNF при нормальном старении и болезни Альцгеймера». Обзоры исследований мозга. 59 (1): 201–20. Дои:10.1016 / j.brainresrev.2008.07.007. HDL:10533/142174. PMID 18708092. S2CID 6589846.
- ^ Шверновский К., Беларби К., Буэ Л. (февраль 2008 г.). «Нейротрофические факторы при болезни Альцгеймера: роль аксонального транспорта». Гены, мозг и поведение. 7 (Дополнение 1): 43–56. Дои:10.1111 / j.1601-183X.2007.00378.x. ЧВК 2228393. PMID 18184369.
- ^ Мендес М.Ф. (2006). «Точный диагноз деменции с ранним началом». Международный журнал психиатрии в медицине. 36 (4): 401–12. Дои:10.2190 / Q6J4-R143-P630-KW41. PMID 17407994. S2CID 43715976.
- ^ Клафки Х.В., Штауфенбиль М., Корнхубер Дж., Вильтфанг Дж. (Ноябрь 2006 г.). «Терапевтические подходы к болезни Альцгеймера». Мозг. 129 (Pt 11): 2840–55. Дои:10.1093 / мозг / awl280. PMID 17018549.
- ^ Деменция: Краткое справочное руководство (PDF). Лондон: (Великобритания) Национальный институт здравоохранения и клинического совершенства. Ноябрь 2006 г. ISBN 978-1-84629-312-2. Архивировано из оригинал (PDF) 27 февраля 2008 г.. Получено 22 февраля 2008.
- ^ Schroeter ML, Stein T, Maslowski N, Neumann J (октябрь 2009 г.). «Нейронные корреляты болезни Альцгеймера и легкого когнитивного нарушения: систематический и количественный метаанализ с участием 1351 пациента». NeuroImage. 47 (4): 1196–206. Дои:10.1016 / j.neuroimage.2009.05.037. ЧВК 2730171. PMID 19463961.
- ^ а б Маккханн Г., Драхман Д., Фолштейн М., Кацман Р., Прайс Д., Стадлан Е.М. (июль 1984 г.). «Клиническая диагностика болезни Альцгеймера: отчет Рабочей группы NINCDS-ADRDA под эгидой Целевой группы Департамента здравоохранения и социальных служб по болезни Альцгеймера». Неврология. 34 (7): 939–44. Дои:10.1212 / wnl.34.7.939. PMID 6610841. S2CID 11646075.
- ^ а б Дюбуа Б., Фельдман Х. Х., Якова С. и др. (Август 2007 г.). «Критерии исследования для диагностики болезни Альцгеймера: пересмотр критериев NINCDS-ADRDA». Ланцет. Неврология. 6 (8): 734–46. Дои:10.1016 / S1474-4422 (07) 70178-3. PMID 17616482. S2CID 7356809.
- ^ Блэкер Д., Альберт М.С., Бассетт С.С., Гоу Р.С., Харрелл Л.Э., Фолштейн М.Ф. (декабрь 1994 г.). «Надежность и обоснованность критериев NINCDS-ADRDA для болезни Альцгеймера. Инициатива Национального института психического здоровья и генетики». Архив неврологии. 51 (12): 1198–204. Дои:10.1001 / archneur.1994.00540240042014. PMID 7986174.
- ^ Американская психиатрическая ассоциация (2000). Диагностическое и статистическое руководство психических расстройств: DSM-IV-TR (4-е издание редакции текста). Вашингтон, округ Колумбия: Американская психиатрическая ассоциация. ISBN 978-0-89042-025-6.
- ^ Ито Н (май 1996 г.). «[Клинические аспекты деменции]». [Хоккайдо Игаку Дзасси] Журнал медицинских наук Хоккайдо (на японском языке). 71 (3): 315–20. PMID 8752526.
- ^ Томбо TN, Макинтайр, штат Нью-Джерси (сентябрь 1992 г.). «Мини-обследование психического состояния: комплексный обзор». Журнал Американского гериатрического общества. 40 (9): 922–35. Дои:10.1111 / j.1532-5415.1992.tb01992.x. PMID 1512391. S2CID 25169596.
- ^ Паскуье Ф (январь 1999 г.). «Ранняя диагностика деменции: нейропсихология». Журнал неврологии. 246 (1): 6–15. Дои:10.1007 / s004150050299. PMID 9987708. S2CID 2108587.
- ^ Харви П.Д., Мориарти П.Дж., Клейнман Л., Койн К., Садовски С.Х., Чен М., Мирски Д.Ф. (2005). «Подтверждение оценки деменции со стороны попечителя: шкала тяжести деменции». Болезнь Альцгеймера и связанные с ней заболевания. 19 (4): 186–94. Дои:10.1097 / 01.wad.0000189034.43203.60. PMID 16327345. S2CID 20238911.
- ^ Антуан С., Антуан П., Гермонпрез П., Фригар Б. (2004). «[Осведомленность о дефиците и анозогнозии при болезни Альцгеймера]». L'Encephale (На французском). 30 (6): 570–77. Дои:10.1016 / S0013-7006 (04) 95472-3. PMID 15738860.
- ^ Круз В.Т., Паис Дж., Тейшейра А., Нуньес Б. (2004). «[Начальные симптомы болезни Альцгеймера: восприятие лица, осуществляющего уход]». Acta Medica Portuguesa (на португальском). 17 (6): 435–44. PMID 16197855.
- ^ Clarfield AM (октябрь 2003 г.). «Снижение распространенности обратимых деменций: обновленный метаанализ». Архивы внутренней медицины. 163 (18): 2219–29. Дои:10.1001 / archinte.163.18.2219. PMID 14557220.
- ^ Сан X, Стеффенс Д.К., Ау Р., Фолштейн М., Саммерград П., Йи Дж., Розенберг И., Мвамбури Д.М., Цю В.К. (май 2008 г.). «Амилоид-ассоциированная депрессия: продромальная депрессия болезни Альцгеймера?». Архив общей психиатрии. 65 (5): 542–50. Дои:10.1001 / archpsyc.65.5.542. ЧВК 3042807. PMID 18458206.
- ^ Гельдмахер Д.С., Whitehouse PJ (май 1997 г.). «Дифференциальный диагноз болезни Альцгеймера». Неврология. 48 (5 Дополнение 6): S2–9. Дои:10.1212 / WNL.48.5_Suppl_6.2S. PMID 9153154. S2CID 30018544.
- ^ Поттер Г.Г., Стеффенс, округ Колумбия (май 2007 г.). «Вклад депрессии в когнитивные нарушения и деменцию у пожилых людей». Невролог. 13 (3): 105–17. Дои:10.1097 / 01.nrl.0000252947.15389.a9. PMID 17495754. S2CID 24569198.
- ^ Zhang S, Smailagic N, Hyde C, Ноэль-Сторр AH, Takwoingi Y, McShane R, Feng J (июль 2014 г.). «(11) C-PIB-PET для ранней диагностики деменции при болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI)». Кокрановская база данных систематических обзоров (7): CD010386. Дои:10.1002 / 14651858.CD010386.pub2. ЧВК 6464750. PMID 25052054.
- ^ Smailagic N, Vacante M, Hyde C, Martin S, Ukoumunne O, Sachpekidis C (январь 2015 г.). "18F-FDG PET для ранней диагностики деменции при болезни Альцгеймера и других деменций у людей с умеренными когнитивными нарушениями (MCI) ». Кокрановская база данных систематических обзоров. 1: CD010632. Дои:10.1002 / 14651858.CD010632.pub2. ЧВК 7081123. PMID 25629415.
- ^ Паттерсон С., Фейтнер Дж. В., Гарсия А., Сюн Г. Ю., Макнайт С., Садовник А. Д. (февраль 2008 г.). «Диагностика и лечение деменции: 1. Оценка риска и первичная профилактика болезни Альцгеймера». CMAJ. 178 (5): 548–56. Дои:10.1503 / cmaj.070796. ЧВК 2244657. PMID 18299540.
- ^ Розендорф С., Бери М.С., Сильверман Дж. М. (2007). «Сердечно-сосудистые факторы риска болезни Альцгеймера». Американский журнал гериатрической кардиологии. 16 (3): 143–49. Дои:10.1111 / j.1076-7460.2007.06696.x. PMID 17483665.
- ^ Динг Дж., Дэвис-Плурд К.Л., Седагат С. и др. (Январь 2020 г.). «Антигипертензивные препараты и риск развития деменции и болезни Альцгеймера: метаанализ данных отдельных участников проспективных когортных исследований». Ланцет. Неврология. 19 (1): 61–70. Дои:10.1016 / С1474-4422 (19) 30393-Х. ЧВК 7391421. PMID 31706889.
- ^ Рейсс А.Б., Вирковски Э. (2007). «Роль ингибиторов HMG-CoA редуктазы в неврологических расстройствах: прогресс на сегодняшний день». Наркотики. 67 (15): 2111–20. Дои:10.2165/00003495-200767150-00001. PMID 17927279. S2CID 29107420.
- ^ Куллер LH (август 2007 г.). «Статины и деменция». Текущие отчеты об атеросклерозе. 9 (2): 154–61. Дои:10.1007 / s11883-007-0012-9. PMID 17877925. S2CID 20488187.
- ^ МакГиннесс Б., Крейг Д., Баллок Р., Малуф Р., Пассмор П. (июль 2014 г.). «Статины для лечения деменции». Кокрановская база данных систематических обзоров. 7 (7): CD007514. Дои:10.1002 / 14651858.CD007514.pub3. PMID 25004278.
- ^ Секели, Калифорния, Город Т, Занди, ПП (2007). НПВП для химиопрофилактики болезни Альцгеймера. Субклеточная биохимия. 42. С. 229–48. Дои:10.1007/1-4020-5688-5_11. ISBN 978-1-4020-5687-1. PMID 17612054.
- ^ Hoozemans JJ, Veerhuis R, Rozemuller JM, Eikelenboom P (февраль 2011 г.). «Успокоение воспаленного мозга: влияние нестероидных противовоспалительных препаратов на патологию болезни Альцгеймера». Мишени для лекарств от ЦНС и неврологических расстройств. 10 (1): 57–67. Дои:10.2174/187152711794488665. PMID 21143138.
- ^ Марджорибанкс Дж., Фаркуар С., Робертс Х., Летаби А., Ли Дж. (Январь 2017 г.). «Длительная гормональная терапия для женщин в перименопаузе и постменопаузе». Кокрановская база данных систематических обзоров. 1: CD004143. Дои:10.1002 / 14651858.CD004143.pub5. ЧВК 6465148. PMID 28093732.
- ^ а б Стерн Y (июль 2006 г.). «Когнитивный резерв и болезнь Альцгеймера». Болезнь Альцгеймера и связанные с ней заболевания. 20 (3 Дополнение 2): S69–74. Дои:10.1097 / 01.wad.0000213815.20177.19. PMID 16917199. S2CID 9827674.
- ^ а б Парадайз М., Купер С., Ливингстон Дж. (Февраль 2009 г.). «Систематический обзор влияния образования на выживаемость при болезни Альцгеймера». Международная психогериатрия. 21 (1): 25–32. Дои:10.1017 / S1041610208008053. PMID 19026089.
- ^ Neergaard L (19 февраля 2011 г.). «Знание двух языков может замедлить развитие болезни Альцгеймера». Денвер Пост. Ассошиэйтед Пресс. Архивировано из оригинал 2 мая 2014 г.
- ^ Cheng ST (сентябрь 2016 г.). «Когнитивный резерв и профилактика деменции: роль физической и когнитивной деятельности». Текущие отчеты психиатрии. 18 (9): 85. Дои:10.1007 / s11920-016-0721-2. ЧВК 4969323. PMID 27481112.
- ^ Фарина Н., Ржавый Дж., Табет Н. (январь 2014 г.). «Влияние упражнений на когнитивные результаты при болезни Альцгеймера: систематический обзор». Международная психогериатрия. 26 (1): 9–18. Дои:10.1017 / S1041610213001385. PMID 23962667. S2CID 24936334.
- ^ а б c Ху Н, Ю. Дж. Т., Тан Л., Ван Ю. Л., Сунь Л., Тан Л. (2013). «Питание и риск болезни Альцгеймера». BioMed Research International (Рассмотрение). 2013: 1–12. Дои:10.1155/2013/524820. ЧВК 3705810. PMID 23865055.
- ^ Solfrizzi V, Panza F, Frisardi V, Seripa D, Logroscino G, Imbimbo BP, Pilotto A (май 2011 г.). «Диета и факторы риска болезни Альцгеймера или профилактика: современные данные». Экспертный обзор нейротерапии. 11 (5): 677–708. Дои:10.1586 / ern.11.56. PMID 21539488. S2CID 27604317.
- ^ Каноски С.Е., Дэвидсон Т.Л. (апрель 2011 г.). «Западное питание и когнитивные нарушения: связь с дисфункцией гиппокампа и ожирением». Физиология и поведение (Рассмотрение). 103 (1): 59–68. Дои:10.1016 / j.physbeh.2010.12.003. ЧВК 3056912. PMID 21167850.
- ^ Solfrizzi V, Capurso C, D'Introno A, Colacicco AM, Santamato A, Ranieri M, Fiore P, Capurso A, Panza F (январь 2008 г.). «Факторы, связанные с образом жизни, при синдромах предменения и деменции». Экспертный обзор нейротерапии. 8 (1): 133–58. Дои:10.1586/14737175.8.1.133. PMID 18088206. S2CID 20897989.
- ^ Сантос К., Коста Дж., Сантос Дж., Ваз-Карнейро А, Лунет Н. (2010). «Потребление кофеина и деменция: систематический обзор и метаанализ». Журнал болезни Альцгеймера. 20 Дополнение 1: S187–204. Дои:10.3233 / JAD-2010-091387. PMID 20182026.
- ^ Нехлиг А (март 2013 г.). «Нейрозащитные эффекты флаванола какао и его влияние на когнитивные способности». Британский журнал клинической фармакологии (Рассмотрение). 75 (3): 716–27. Дои:10.1111 / j.1365-2125.2012.04378.x. ЧВК 3575938. PMID 22775434.
- ^ Stoclet JC, Schini-Kerth V (март 2011 г.). «[Диетические флавоноиды и здоровье человека]». Annales Pharmaceutiques Françaises. 69 (2): 78–90. Дои:10.1016 / j.pharma.2010.11.004. PMID 21440100.
- ^ Оно К., Ямада М. (апрель 2012 г.). «Витамин А и болезнь Альцгеймера». Международная ассоциация гериатрии и геронтологии (Рассмотрение). 12 (2): 180–88. Дои:10.1111 / j.1447-0594.2011.00786.x. PMID 22221326. S2CID 205507828.
- ^ Лернер А.Дж., Густав-Ротенберг К., Смит С., Касадесус Г. (март – апрель 2012 г.). «Ретиноиды для лечения болезни Альцгеймера». БиоФакторы. 38 (2): 84–89. Дои:10.1002 / биоф.196. PMID 22419567. S2CID 27616679.
- ^ Хео Дж. Х., Ли К. М. (март 2013 г.). «Возможная роль антиоксиданта витамина С в лечении и профилактике болезни Альцгеймера». Американский журнал болезни Альцгеймера и других деменций (Рассмотрение). 28 (2): 120–25. Дои:10.1177/1533317512473193. PMID 23307795. S2CID 27132196.
- ^ Бутби Л.А., Деринг П.Л. (декабрь 2005 г.). «Витамин С и витамин Е при болезни Альцгеймера». Летопись фармакотерапии. 39 (12): 2073–80. Дои:10.1345 / aph.1E495. PMID 16227450. S2CID 46645284.
- ^ а б Фарина Н., Ллевеллин Д., Исаак М.Г., Табет Н. (апрель 2017 г.). «Витамин Е от деменции Альцгеймера и легких когнитивных нарушений». Кокрановская база данных систематических обзоров. 4: CD002854. Дои:10.1002 / 14651858.CD002854.pub5. ЧВК 6478142. PMID 28418065.
- ^ Лоэф М, Шраузер Г.Н., Валах Х (2011). «Селен и болезнь Альцгеймера: систематический обзор». Журнал болезни Альцгеймера (Рассмотрение). 26 (1): 81–104. Дои:10.3233 / JAD-2011-110414. PMID 21593562. S2CID 30661765.
- ^ Loef M, von Stillfried N, Walach H (сентябрь 2012 г.). «Цинковая диета и болезнь Альцгеймера: систематический обзор». Пищевая неврология (Рассмотрение). 15 (5): 2–12. Дои:10.1179 / 1476830512Y.0000000010. PMID 22583839. S2CID 23381337.
- ^ Аван А., Hoogenraad TU (2015). «Цинк и медь при болезни Альцгеймера». Журнал болезни Альцгеймера (Рассмотрение). 46 (1): 89–92. Дои:10.3233 / JAD-150186. PMID 25835420.
- ^ Малуф Р., Гримли Эванс Дж. (Октябрь 2008 г.). «Фолиевая кислота с витамином B12 или без него для профилактики и лечения здоровых пожилых людей и людей с деменцией». Кокрановская база данных систематических обзоров (4): CD004514. Дои:10.1002 / 14651858.CD004514.pub2. PMID 18843658.
- ^ Wald DS, Kasturiratne A, Simmonds M (июнь 2010 г.). «Влияние фолиевой кислоты с другими витаминами группы В или без них на снижение когнитивных функций: метаанализ рандомизированных исследований». Американский журнал медицины. 123 (6): 522–527.e2. Дои:10.1016 / j.amjmed.2010.01.017. PMID 20569758.
- ^ Cunnane SC, Chouinard-Watkins R, Castellano CA, Barberger-Gateau P (январь 2013 г.). «Гомеостаз докозагексаеновой кислоты, старение мозга и болезнь Альцгеймера: можем ли мы согласовать доказательства?». Простагландины, лейкотриены и незаменимые жирные кислоты. 88 (1): 61–70. Дои:10.1016 / j.plefa.2012.04.006. PMID 22575581.
- ^ Буркхардт М., Херке М., Вустманн Т., Ватцке С., Лангер Г., Финк А. (апрель 2016 г.). «Жирные кислоты омега-3 для лечения деменции». Кокрановская база данных систематических обзоров. 4: CD009002. Дои:10.1002 / 14651858.CD009002.pub3. ЧВК 7117565. PMID 27063583.
- ^ Хамагути Т., Оно К., Ямада М. (октябрь 2010 г.). «ОБЗОР: Куркумин и болезнь Альцгеймера». ЦНС нейробиология и терапия (рассмотрение). 16 (5): 285–97. Дои:10.1111 / j.1755-5949.2010.00147.x. ЧВК 6493893. PMID 20406252.
- ^ Биркс Дж., Гримли Эванс Дж. (Январь 2009 г.). «Гинкго билоба при когнитивных нарушениях и деменции». Кокрановская база данных систематических обзоров (1): CD003120. Дои:10.1002 / 14651858.CD003120.pub3. PMID 19160216.
- ^ Кришнан С., Кэрнс Р., Ховард Р. (апрель 2009 г.). Кришнан С (ред.). «Каннабиноиды для лечения деменции». Кокрановская база данных систематических обзоров (2): CD007204. Дои:10.1002 / 14651858.CD007204.pub2. ЧВК 7197039. PMID 19370677.
- ^ Билькей-Горзо А (декабрь 2012 г.). «Эндоканнабиноидная система при нормальном и патологическом старении мозга». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 367 (1607): 3326–41. Дои:10.1098 / rstb.2011.0388. ЧВК 3481530. PMID 23108550.
- ^ а б c Биркс Дж. С., Харви Р. Дж. (Июнь 2018 г.). «Донепезил от слабоумия, вызванного болезнью Альцгеймера». Кокрановская база данных систематических обзоров. 6: CD001190. Дои:10.1002 / 14651858.CD001190.pub3. ЧВК 6513124. PMID 29923184.
- ^ а б Биркс JS, Гримли Эванс Дж. (Апрель 2015 г.). Биркс Дж.С. (ред.). «Ривастигмин от болезни Альцгеймера». Кокрановская база данных систематических обзоров (4): CD001191. Дои:10.1002 / 14651858.CD001191.pub3. PMID 25858345.
- ^ Финк Х.А., Линскенс Э.Дж., Макдональд Р. и др. (Май 2020 г.). «Польза и вред рецептурных препаратов и добавок для лечения клинической деменции альцгеймеровского типа». Анналы внутренней медицины. 172 (10): 656–668. Дои:10.7326 / M19-3887. PMID 32340037. S2CID 216595473.
- ^ Геула К., Месулам М.М. (1995). «Холинэстеразы и патология болезни Альцгеймера». Болезнь Альцгеймера и связанные с ней заболевания. 9 Дополнение 2: 23–28. Дои:10.1097/00002093-199501002-00005. PMID 8534419.
- ^ Шталь С.М. (ноябрь 2000 г.). «Новые ингибиторы холинэстеразы при болезни Альцгеймера. Часть 2: иллюстрирующие механизмы их действия». Журнал клинической психиатрии. 61 (11): 813–14. Дои:10.4088 / JCP.v61n1101. PMID 11105732.
- ^ а б Биркс Дж (январь 2006 г.). Биркс Дж (ред.). «Ингибиторы холинэстеразы при болезни Альцгеймера». Кокрановская база данных систематических обзоров (1): CD005593. Дои:10.1002 / 14651858.CD005593. PMID 16437532.
- ^ Рашетти Р., Альбанезе Э, Ванакор Н., Маггини М. (ноябрь 2007 г.). «Ингибиторы холинэстеразы при легких когнитивных нарушениях: систематический обзор рандомизированных исследований». PLOS Медицина. 4 (11): e338. Дои:10.1371 / journal.pmed.0040338. ЧВК 2082649. PMID 18044984.
- ^ Аллдредж Б.К., Корелли Р.Л., Эрнст М.Э., Гульельмо Б.Дж., Якобсон П.А., Краджан В.А., Уильямс Б.Р. (2013). Прикладная терапия: клиническое применение лекарств (10-е изд.). Балтимор: Wolters Kluwer Health / Lippincott Williams & Wilkins. п. 2385. ISBN 978-1-60913-713-7.
- ^ а б Lipton SA (февраль 2006 г.). «Смена парадигмы нейрозащиты посредством блокады рецепторов NMDA: мемантин и не только». Обзоры природы. Открытие наркотиков. 5 (2): 160–70. Дои:10.1038 / nrd1958. PMID 16424917. S2CID 21379258.
- ^ «Мемантин». Национальная медицинская библиотека США (Medline). 4 января 2004 г. Архивировано с оригинал 22 февраля 2010 г.. Получено 3 февраля 2010.
- ^ МакШейн Р., Вестби М.Дж., Робертс Э., Минакаран Н., Шнайдер Л., Фарримонд Л.Э., Мааян Н., Уэр Дж., Дебаррос Дж. (Май 2019 г.). «Мемантин от слабоумия». Кокрановская база данных систематических обзоров. 3 (3): CD003154. Дои:10.1002 / 14651858.CD003154.pub6. ЧВК 6425228. PMID 30891742.
- ^ «Названия предписывающей информации» (PDF). Лесная фармацевтика. Архивировано из оригинал (PDF) 27 февраля 2008 г.. Получено 19 февраля 2008. (основной источник)
- ^ Райна П., Сантагуида П., Исмаила А., Паттерсон С., Коуэн Д., Левин М., Букер Л., Оремус М. (март 2008 г.). «Эффективность ингибиторов холинэстеразы и мемантина для лечения деменции: обзор данных для руководства по клинической практике». Анналы внутренней медицины. 148 (5): 379–97. Дои:10.7326/0003-4819-148-5-200803040-00009. PMID 18316756. S2CID 22235353.
- ^ Баллард С., Уэйт Дж. (Январь 2006 г.). Баллард CG (ред.).«Эффективность атипичных антипсихотиков для лечения агрессии и психозов при болезни Альцгеймера». Кокрановская база данных систематических обзоров (1): CD003476. Дои:10.1002 / 14651858.CD003476.pub2. PMID 16437455.
- ^ Баллард С., Хэнни М.Л., Теодулу М., Дуглас С., МакШейн Р., Косаковски К., Гилл Р., Ющак Е., Ю. Л. М., Якоби Р. (февраль 2009 г.). «Исследование отмены антипсихотических препаратов при деменции (DART-AD): долгосрочное наблюдение рандомизированного плацебо-контролируемого исследования». Ланцетная неврология. 8 (2): 151–57. Дои:10.1016 / S1474-4422 (08) 70295-3. PMID 19138567. S2CID 23000439. Сложить резюме.
- ^ Declercq T, Petrovic M, Azermai M, Vander Stichele R, De Sutter AI, van Driel ML, Christiaens T (март 2013 г.). «Прекращение приема против продолжения приема антипсихотических препаратов для лечения поведенческих и психологических симптомов у пожилых людей с деменцией» (PDF). Кокрановская база данных систематических обзоров. 3 (3): CD007726. Дои:10.1002 / 14651858.CD007726.pub2. HDL:1854 / LU-3109108. PMID 23543555.
- ^ а б c d е ж грамм Рабинс П.В., Блэкер Д., Ровнер Б.В. и др. (Руководящий комитет по практическим рекомендациям) (декабрь 2007 г.). «Практическое руководство Американской психиатрической ассоциации по лечению пациентов с болезнью Альцгеймера и другими деменциями. Второе издание». Американский журнал психиатрии. 164 (12 Suppl): 5–56. PMID 18340692.
- ^ Боттино С.М., Карвалью И.А., Альварес А.М. и др. (Декабрь 2005 г.). «Когнитивная реабилитация в сочетании с медикаментозным лечением у пациентов с болезнью Альцгеймера: пилотное исследование». Клиническая реабилитация. 19 (8): 861–69. Дои:10.1191 / 0269215505cr911oa. PMID 16323385. S2CID 21290731.
- ^ Дуди Р.С., Стивенс Дж. К., Бек С. и др. (Май 2001 г.). «Параметр практики: лечение деменции (обзор, основанный на фактах). Отчет Подкомитета по стандартам качества Американской академии неврологии». Неврология. 56 (9): 1154–66. Дои:10.1212 / WNL.56.9.1154. PMID 11342679. S2CID 10711725.
- ^ Hermans DG, Htay UH, McShane R (январь 2007 г.). «Немедикаментозные вмешательства при блуждании людей с деменцией в домашних условиях». Кокрановская база данных систематических обзоров (1): CD005994. Дои:10.1002 / 14651858.CD005994.pub2. ЧВК 6669244. PMID 17253573.
- ^ Робинсон Л., Хатчингс Д., Дикинсон Х.О., Корнер Л., Бейер Ф., Финч Т., Хьюз Дж., Ваноли А., Баллард С., Бонд Дж. (Январь 2007 г.). «Эффективность и приемлемость нефармакологических вмешательств для уменьшения блуждания при деменции: систематический обзор». Международный журнал гериатрической психиатрии. 22 (1): 9–22. Дои:10.1002 / гпс.1643. PMID 17096455. S2CID 45660235.
- ^ Abraha I, Rimland JM, Trotta FM, Dell'Aquila G, Cruz-Jentoft A, Petrovic M, Gudmundsson A, Soiza R, O'Mahony D, Guaita A, Cherubini A (март 2017 г.). «Систематический обзор систематических обзоров нефармакологических вмешательств для лечения поведенческих нарушений у пожилых пациентов с деменцией. Серия SENATOR-OnTop». BMJ Open. 7 (3): e012759. Дои:10.1136 / bmjopen-2016-012759. ЧВК 5372076. PMID 28302633.
- ^ Чунг Дж. К., Лай К. К., Чанг П. М., Французский HP (2002). «Сноэзелен от слабоумия». Кокрановская база данных систематических обзоров (4): CD003152. Дои:10.1002 / 14651858.CD003152. PMID 12519587.
- ^ Вудс Б., О'Филбин Л., Фаррелл Е.М., Спектор А.Е., Оррелл М. (март 2018 г.). «Воспоминания о терапии деменции». Кокрановская база данных систематических обзоров. 3: CD001120. Дои:10.1002 / 14651858.CD001120.pub3. ЧВК 6494367. PMID 29493789.
- ^ Zetteler J (ноябрь 2008 г.). «Эффективность терапии имитации присутствия для людей с деменцией: систематический обзор и метаанализ». Старение и психическое здоровье. 12 (6): 779–85. Дои:10.1080/13607860802380631. PMID 19023729. S2CID 39529938.
- ^ Нил М., Бартон Райт П. (2003). Нил М (ред.). «Валидационная терапия деменции». Кокрановская база данных систематических обзоров (3): CD001394. Дои:10.1002 / 14651858.CD001394. PMID 12917907.
- ^ Чунг Дж. К., Лай К. К., Чанг П. М., Французский HP (2002). Чанг JC (ред.). «Сноэзелен от слабоумия». Кокрановская база данных систематических обзоров (4): CD003152. Дои:10.1002 / 14651858.CD003152. PMID 12519587. (актуально на 2009 год)
- ^ Спектор А., Торгримсен Л., Вудс Б., Ройан Л., Дэвис С., Баттерворт М., Оррелл М. (сентябрь 2003 г.). «Эффективность научно-обоснованной программы терапии когнитивной стимуляции для людей с деменцией: рандомизированное контролируемое исследование». Британский журнал психиатрии. 183 (3): 248–54. Дои:10.1192 / bjp.183.3.248. PMID 12948999.
- ^ Гитлин Л.Н., Коркоран М., Винтер Л., Бойс А., Хаук В.В. (февраль 2001 г.). «Рандомизированное контролируемое испытание вмешательства в домашнюю среду: влияние на эффективность и расстройство лиц, осуществляющих уход, и на повседневное функционирование людей с деменцией». Геронтолог. 41 (1): 4–14. Дои:10.1093 / geront / 41.1.4. PMID 11220813.
- ^ Гитлин Л.Н., Хаук В.В., Деннис М.П., Винтер Л. (март 2005 г.). «Поддержание эффективности программы развития навыков домашней среды для членов семьи и лиц, страдающих болезнью Альцгеймера и связанными с ней расстройствами». Журналы геронтологии. Серия A, Биологические и медицинские науки. 60 (3): 368–74. Дои:10.1093 / gerona / 60.3.368. PMID 15860476.
- ^ «Лечение поведенческих и психиатрических симптомов». Ассоциация Альцгеймера. 2006. Архивировано с оригинал 25 сентября 2006 г.. Получено 25 сентября 2006.
- ^ Данн Т.Э., Неаргардер С.А., Чиполлони ПБ, Кронин-Голомб А (август 2004 г.). «Визуальный контраст увеличивает потребление пищи и жидкости при запущенной болезни Альцгеймера». Клиническое питание. 23 (4): 533–38. Дои:10.1016 / j.clnu.2003.09.015. PMID 15297089.
- ^ Дудек С.Б. (2007). Основы питания для медсестер. Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 360. ISBN 978-0-7817-6651-7. Получено 19 августа 2008.
- ^ Деннехи C (2006). «Анализ прав пациентов: деменция и введение ПЭГ». Британский журнал медсестер. 15 (1): 18–20. Дои:10.12968 / bjon.2006.15.1.20303. PMID 16415742.
- ^ Чернов Р. (апрель 2006 г.). «Питание через зонд для пациентов с деменцией». Питание в клинической практике. 21 (2): 142–46. Дои:10.1177/0115426506021002142. PMID 16556924.
- ^ Гамбасси Г., Ланди Ф., Лапане К.Л., Сгадари А., Мор В., Бернабеи Р. (июль 1999 г.). «Предикторы смертности у пациентов с болезнью Альцгеймера, проживающих в домах престарелых». Журнал неврологии, нейрохирургии и психиатрии. 67 (1): 59–65. Дои:10.1136 / jnnp.67.1.59. ЧВК 1736445. PMID 10369823.
- ^ Медицинские проблемы:
- Глава B (январь 2003 г.). «Паллиативная помощь людям с деменцией». Медсестра на дому. 21 (1): 53–60, тест 61. Дои:10.1097/00004045-200301000-00012. PMID 12544465.
- Фридлендер А.Х., Норман Д.К., Малер М.Э., Норман К.М., Ягиела Дж.А. (сентябрь 2006 г.). «Болезнь Альцгеймера: психопатология, лечение и стоматологические последствия». Журнал Американской стоматологической ассоциации. 137 (9): 1240–51. Дои:10.14219 / jada.archive.2006.0381. PMID 16946428.
- Белмин Дж (2007). «Практические рекомендации по диагностике и лечению потери веса при болезни Альцгеймера: консенсус на основе оценок соответствия большой группы экспертов». Журнал питания, здоровья и старения. 11 (1): 33–37. PMID 17315078.
- Маккарри С.М., Гиббонс Л.Э., Логсдон Р.Г., Витиелло М., Тери Л. (октябрь 2003 г.). «Обучение лиц, осуществляющих уход, по изменению практики гигиены сна пациентов с деменцией: проект NITE-AD». Журнал Американского гериатрического общества. 51 (10): 1455–60. Дои:10.1046 / j.1532-5415.2003.51466.x. PMID 14511168. S2CID 24065377.
- Perls TT, Herget M (декабрь 1995 г.). «Более высокие показатели респираторных инфекций в отделении особой помощи при болезни Альцгеймера и успешное вмешательство». Журнал Американского гериатрического общества. 43 (12): 1341–44. Дои:10.1111 / j.1532-5415.1995.tb06611.x. PMID 7490383. S2CID 30067677.
- ^ Шега Дж. В., Левин А., Хугам Г. В., Кокс-Хейли Д., Лучинс Д., Ханрахан П., Стокинг С., Сакс Г. А. (апрель 2003 г.). «Превосходство паллиативной помощи при оказании помощи при болезни Альцгеймера (МИР): описание программы». Журнал паллиативной медицины. 6 (2): 315–20. Дои:10.1089/109662103764978641. PMID 12854952. S2CID 6072807.
- ^ а б Zanetti O, Solerte SB, Cantoni F (2009). «Ожидаемая продолжительность жизни при болезни Альцгеймера (AD)». Архив геронтологии и гериатрии. 49 Дополнение 1: 237–43. Дои:10.1016 / j.archger.2009.09.035. PMID 19836639.
- ^ а б Mölsä PK, Marttila RJ, Rinne UK (март 1995 г.). «Долгосрочная выживаемость и предикторы смертности при болезни Альцгеймера и мультиинфарктной деменции». Acta Neurologica Scandinavica. 91 (3): 159–64. Дои:10.1111 / j.1600-0404.1995.tb00426.x. PMID 7793228. S2CID 19724937.
- ^ Боуэн Дж. Д., Мальтер А. Д., Шеппард Л., Кукулл В. А., Маккормик В. К., Тери Л., Ларсон Э. Б. (август 1996 г.). «Предикторы смертности пациентов с вероятной болезнью Альцгеймера». Неврология. 47 (2): 433–39. Дои:10.1212 / wnl.47.2.433. PMID 8757016. S2CID 24961809.
- ^ Ларсон Э. Б., Шадлен М. Ф., Ван Л., Маккормик В. К., Боуэн Д. Д., Тери Л., Кукулл В. А. (апрель 2004 г.). «Выживаемость после первоначального диагноза болезни Альцгеймера». Анналы внутренней медицины. 140 (7): 501–09. Дои:10.7326/0003-4819-140-7-200404060-00008. PMID 15068977. S2CID 27410149.
- ^ Джаггер С., Кларк М., Стоун А. (январь 1995 г.). «Предикторы выживания с болезнью Альцгеймера: исследование на уровне сообщества». Психологическая медицина. 25 (1): 171–77. Дои:10.1017 / S0033291700028191. PMID 7792352.
- ^ Dodge HH, Шен С., Пандав Р., ДеКоски СТ, Гангули М. (февраль 2003 г.). «Функциональные переходы и ожидаемая продолжительность активной жизни, связанные с болезнью Альцгеймера». Архив неврологии. 60 (2): 253–59. Дои:10.1001 / archneur.60.2.253. PMID 12580712.
- ^ а б Гангули М., Додж Х. Х., Шен С., Пандав Р. С., ДеКоски СТ (май 2005 г.). «Болезнь Альцгеймера и смертность: 15-летнее эпидемиологическое исследование». Архив неврологии. 62 (5): 779–84. Дои:10.1001 / archneur.62.5.779. PMID 15883266.
- ^ а б c Бермехо-Пареха Ф., Бенито-Леон Дж., Вега С., Медрано М.Дж., Роман ГК (январь 2008 г.). «Заболеваемость и подтипы деменции у трех пожилых людей в центральной Испании». Журнал неврологических наук. 264 (1–2): 63–72. Дои:10.1016 / j.jns.2007.07.021. PMID 17727890. S2CID 34341344.
- ^ а б c Ди Карло А., Балдерески М., Амадуччи Л., Лепор В., Бракко Л., Магги С., Бонайуто С., Периссинотто Е., Скарлато Г., Фарчи Г., Инзитари Д. (январь 2002 г.). «Заболеваемость деменцией, болезнью Альцгеймера и сосудистой деменцией в Италии. Исследование ILSA». Журнал Американского гериатрического общества. 50 (1): 41–48. Дои:10.1046 / j.1532-5415.2002.50006.x. PMID 12028245. S2CID 22576935.
- ^ Андерсен К., Лаунер Л.Дж., Дьюи М.Э. и др. (Декабрь 1999 г.). «Гендерные различия в заболеваемости БА и сосудистой деменции: исследования EURODEM. Группа исследований заболеваемости EURODEM». Неврология. 53 (9): 1992–97. Дои:10.1212 / wnl.53.9.1992. PMID 10599770. S2CID 22725252.
- ^ Техада-Вера Б. (2013). Смертность от болезни Альцгеймера в США: данные за 2000 и 2010 гг. Хяттсвилл, Мэриленд: Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний, Национальный центр статистики здравоохранения.
- ^ 2000 США оценки:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (август 2003 г.). «Болезнь Альцгеймера среди населения США: оценки распространенности по данным переписи 2000 года». Архив неврологии. 60 (8): 1119–22. Дои:10.1001 / archneur.60.8.1119. PMID 12925369.
- «Профили общих демографических характеристик, перепись населения и жилищного фонда 2000 г., США» (PDF). Бюро переписи населения США. 2001. Архивировано с оригинал (PDF) 19 августа 2008 г.. Получено 27 августа 2008.
- ^ а б Ферри С.П., Принц М., Брейн С., Бродати Н., Фратиглиони Л., Гангули М., Холл К., Хасегава К., Хендри Н., Хуанг И., Йорм А., Мазерс С., Менезес П.Р., Риммер Е., Сказуфка М. (декабрь 2005 г.). «Глобальная распространенность деменции: исследование консенсуса Delphi». Ланцет. 366 (9503): 2112–17. Дои:10.1016 / S0140-6736 (05) 67889-0. ЧВК 2850264. PMID 16360788.
- ^ Всемирная организация здравоохранения (2006 г.). Неврологические расстройства: проблемы общественного здравоохранения. Швейцария: Всемирная организация здравоохранения. С. 204–07. ISBN 978-92-4-156336-9. Архивировано из оригинал 10 февраля 2010 г.
- ^ Оценка распространенности на 2006 год:
- Брукмейер Р., Джонсон Э., Зиглер-Грэм К., Арриги Х. М. (июль 2007 г.). «Прогнозирование глобального бремени болезни Альцгеймера». Болезнь Альцгеймера и деменция. 3 (3): 186–91. CiteSeerX 10.1.1.729.847. Дои:10.1016 / j.jalz.2007.04.381. PMID 19595937. S2CID 15536204. Архивировано из оригинал 7 декабря 2008 г.. Получено 18 июн 2008.
- "Особенности" (PDF). Перспективы народонаселения мира: редакция 2006 г.. Рабочий документ № ESA / P / WP.202. Отдел народонаселения Департамента по экономическим и социальным вопросам Организации Объединенных Наций. 2007. Архивировано с оригинал (PDF) 19 августа 2008 г.. Получено 27 августа 2008.
- ^ Огюст Д .:
- Альцгеймер А (1907). "Über eine eigenartige Erkrankung der Hirnrinde" [Об особом заболевании коры головного мозга]. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin (на немецком). 64 (1–2): 146–48.
- Альцгеймер А (1987). Перевод Х. Гринсона. «О своеобразном заболевании коры головного мозга. Автор Алоис Альцгеймер, 1907 г. (Перевод Л. Ярвика и Х. Гринсона)». Болезнь Альцгеймера и связанные с ней заболевания. 1 (1): 3–8. PMID 3331112.
- Ульрике М, Конрад М (2003). Альцгеймер: жизнь врача и карьера болезни. Нью-Йорк: издательство Колумбийского университета. п.270. ISBN 978-0-231-11896-5.
- ^ Берриос Г.Е. (1990). «Болезнь Альцгеймера: концептуальная история». Int. J. Geriatr. Психиатрия. 5 (6): 355–65. Дои:10.1002 / GPS.930050603. S2CID 145155424.
- ^ Крепелин Эмиль (2007). Клиническая психиатрия: Учебник для студентов и врачей (Перепечатка). Перевод Дифендорфа А. Росс. Kessinger Publishing. п. 568. ISBN 978-1-4325-0833-3.
- ^ Кацман Р., Терри Р.Д., Бик К.Л., ред. (1978). Болезнь Альцгеймера: старческое слабоумие и связанные с ней заболевания. Нью-Йорк: Raven Press. п. 595. ISBN 978-0-89004-225-0.
- ^ Боллер Ф., Форбс ММ (июнь 1998 г.). «История деменции и деменции в истории: обзор». Журнал неврологических наук. 158 (2): 125–33. Дои:10.1016 / S0022-510X (98) 00128-2. PMID 9702682. S2CID 42399340.
- ^ Амадуччи Л.А., Рокка В.А., Шенберг Б.С. (ноябрь 1986 г.). «Происхождение различия между болезнью Альцгеймера и старческим слабоумием: как история может прояснить нозологию». Неврология. 36 (11): 1497–9. Дои:10.1212 / wnl.36.11.1497. PMID 3531918. S2CID 7689479.
- ^ Аллегри Р.Ф., Бутман Дж., Аризага Р.Л., Махнички Дж., Серрано С., Тарагано Ф. Э., Сарасола Д., Лон Л. (август 2007 г.). «Экономические последствия деменции в развивающихся странах: оценка стоимости деменции типа Альцгеймера в Аргентине». Международная психогериатрия. 19 (4): 705–18. Дои:10.1017 / S1041610206003784. PMID 16870037. S2CID 41247271.
- ^ Сух Г.Х., Кнапп М., Кан CJ (август 2006 г.). «Экономические издержки деменции в Корее, 2002». Международный журнал гериатрической психиатрии. 21 (8): 722–28. Дои:10.1002 / гпс.1552. PMID 16858741. S2CID 24138151.
- ^ Вимо А, Йонссон Л., Винблад Б. (2006). «Оценка распространенности деменции в мире и прямых затрат на нее в 2003 году». Деменция и гериатрические когнитивные расстройства. 21 (3): 175–81. Дои:10.1159/000090733. PMID 16401889. S2CID 11304720.
- ^ а б c Мур MJ, Zhu CW, Clipp EC (июль 2001 г.). «Неформальные затраты на уход за деменцией: оценки из Национального лонгитюдного исследования лиц, осуществляющих уход». Журналы геронтологии. Серия B, Психологические и социальные науки. 56 (4): S219–28. Дои:10.1093 / geronb / 56.4.S219. PMID 11445614.
- ^ Jönsson L, Eriksdotter Jönhagen M, et al. (Май 2006 г.). «Детерминанты затрат на лечение пациентов с болезнью Альцгеймера». Международный журнал гериатрической психиатрии. 21 (5): 449–59. Дои:10.1002 / гпс.1489. PMID 16676288. S2CID 20193233.
- ^ а б «Исследование болезни Альцгеймера, проведенное компанией MetLife: опыт ухода» (PDF). Институт зрелого рынка MetLife. Август 2006. Архивировано с оригинал (PDF) 8 января 2011 г.. Получено 5 февраля 2011.
- ^ Шнайдер Дж., Мюррей Дж., Банерджи С., Манн А. (август 1999 г.). «EUROCARE: межнациональное исследование совместно проживающих супругов, осуществляющих уход за людьми с болезнью Альцгеймера: I - Факторы, связанные с бременем опекунов». Международный журнал гериатрической психиатрии. 14 (8): 651–61. Дои:10.1002 / (SICI) 1099-1166 (199908) 14: 8 <651 :: AID-GPS992> 3.0.CO; 2-B. PMID 10489656.
- ^ Мюррей Дж., Шнайдер Дж., Банерджи С., Манн А. (август 1999 г.). «EUROCARE: межнациональное исследование совместно проживающих супругов, осуществляющих уход за людьми с болезнью Альцгеймера: II - Качественный анализ опыта ухода». Международный журнал гериатрической психиатрии. 14 (8): 662–67. Дои:10.1002 / (SICI) 1099-1166 (199908) 14: 8 <662 :: AID-GPS993> 3.0.CO; 2-4. PMID 10489657.
- ^ а б Чжу К.В., Сано М. (2006). «Экономические соображения в лечении болезни Альцгеймера». Клинические вмешательства при старении. 1 (2): 143–54. Дои:10.2147 / ciia.2006.1.2.143. ЧВК 2695165. PMID 18044111.
- ^ Гоглер Дж. Э., Кейн Р. Л., Кейн Р. А., Новичок Р. (апрель 2005 г.). «Раннее использование услуг по месту жительства и его влияние на помещение в учреждения по уходу за деменцией». Геронтолог. 45 (2): 177–85. Дои:10.1093 / geront / 45.2.177. PMID 15799982.
- ^ Ричи К., Лавстон С. (ноябрь 2002 г.). «Деменции». Ланцет. 360 (9347): 1759–66. Дои:10.1016 / S0140-6736 (02) 11667-9. PMID 12480441. S2CID 21404062.
- ^ Бродаты Х., Хаджи-Павлович Д. (сентябрь 1990 г.). «Психосоциальные эффекты для лиц, осуществляющих уход за людьми с деменцией». Австралийский и новозеландский журнал психиатрии. 24 (3): 351–61. Дои:10.3109/00048679009077702. PMID 2241719. S2CID 11788466.
- ^ Дональдсон С., Тарриер Н., Бернс А. (апрель 1998 г.). «Детерминанты стресса опекуна при болезни Альцгеймера». Международный журнал гериатрической психиатрии. 13 (4): 248–56. Дои:10.1002 / (SICI) 1099-1166 (199804) 13: 4 <248 :: AID-GPS770> 3.0.CO; 2-0. PMID 9646153.
- ^ Пьюзи Х., Ричардс Д. (май 2001 г.). «Систематический обзор эффективности психосоциальных вмешательств для лиц, осуществляющих уход за людьми с деменцией». Старение и психическое здоровье. 5 (2): 107–19. Дои:10.1080/13607860120038302. PMID 11511058. S2CID 32517015.
- ^ Бэйли Дж. (2000). Ирис: воспоминания Айрис Мердок. Лондон: Abacus. ISBN 978-0-349-11215-2. OCLC 41960006.
- ^ Спаркс N (1996). Записная книжка. Торндайк, Мэн: Thorndike Press. п.268. ISBN 978-0-7862-0821-0.
- ^ "Танматра". Webindia123.com. Архивировано из оригинал 6 ноября 2007 г.. Получено 24 января 2008.
- ^ Огивара Х (2004). Ашита-но Киоку (на японском языке). Токио: Кобунша. ISBN 978-4-334-92446-1. OCLC 57352130.
- ^ Манро А. (2001). Ненависть, Дружба, Ухаживание, Любовь, Брак: Истории. Нью-Йорк: A.A. Кнопф. ISBN 978-0-375-41300-1. OCLC 46929223.
- ^ «Малькольм и Барбара: история любви». Dfgdocs. Архивировано из оригинал 24 мая 2008 г.. Получено 24 января 2008.
- ^ «Малькольм и Барбара: история любви». BBC Кембриджшир. Архивировано из оригинал 10 ноября 2012 г.. Получено 2 марта 2008.
- ^ Планкетт Дж. (7 августа 2007 г.). "Создатель фильма о болезни Альцгеймера встретится с адвокатами ITV". Лондон: Guardian Media. Архивировано из оригинал 15 января 2008 г.. Получено 24 января 2008.
- ^ Каммингс Дж. Л., Морсторф Т., Чжун К. (июль 2014 г.). «Разработка лекарств от болезни Альцгеймера: мало кандидатов, частые неудачи». Исследования и терапия болезни Альцгеймера. 6 (4): 37. Дои:10.1186 / alzrt269. ЧВК 4095696. PMID 25024750.
- ^ Гутис, Филипп С. (22 марта 2019 г.). «Испытание препарата против болезни Альцгеймера дало мне надежду, и затем оно закончилось». Нью-Йорк Таймс. Получено 25 марта 2019.
- ^ Lashuel HA, Hartley DM, Balakhaneh D, Aggarwal A, Teichberg S, Callaway DJ (ноябрь 2002 г.). «Новый класс ингибиторов образования фибрилл бета-амилоида. Значение механизма патогенеза болезни Альцгеймера». Журнал биологической химии. 277 (45): 42881–90. Дои:10.1074 / jbc.M206593200. PMID 12167652.
- ^ Додель Р., Нефф Ф., Ноелкер С., Пул Р., Дю Й., Бахер М., Эртель В. (март 2010 г.). «Внутривенные иммуноглобулины как лечение болезни Альцгеймера: обоснование и текущие данные». Наркотики. 70 (5): 513–28. Дои:10.2165/11533070-000000000-00000. PMID 20329802. S2CID 40577156. Архивировано из оригинал 17 сентября 2011 г.
- ^ Вакцинация:
- Hawkes CA, McLaurin J (ноябрь 2007 г.). «Иммунотерапия как лечение болезни Альцгеймера». Экспертный обзор нейротерапии. 7 (11): 1535–48. Дои:10.1586/14737175.7.11.1535. PMID 17997702. S2CID 41759093.
- Соломон Б (июнь 2007 г.). «Клинические иммунологические подходы к лечению болезни Альцгеймера». Заключение эксперта по исследуемым препаратам. 16 (6): 819–28. Дои:10.1517/13543784.16.6.819. PMID 17501694. S2CID 45559356.
- Вудхаус А, Диксон ТК, Викерс Дж.С. (2007). «Стратегии вакцинации от болезни Альцгеймера: новая надежда?». Наркотики и старение. 24 (2): 107–19. Дои:10.2165/00002512-200724020-00003. PMID 17313199. S2CID 28279428.
- ^ «Исследование по оценке ACC-001 у субъектов с болезнью Альцгеймера от легкой до умеренной». Клинические испытания. Национальные институты здоровья США. 11 марта 2008. Архивировано с оригинал 30 июля 2013 г.. Получено 5 июн 2008.
- ^ «Исследование по оценке безопасности, переносимости и иммуногенности ACC-001 у субъектов с болезнью Альцгеймера». Национальные институты здоровья США. Архивировано из оригинал 29 октября 2008 г.. Получено 5 июн 2008.
- ^ «Испытания вакцины против болезни Альцгеймера приостановлены из соображений безопасности». Medpage сегодня. 18 апреля 2008 г. Архивировано с оригинал 23 апреля 2008 г.. Получено 14 июн 2008.
- ^ «Бапинеузумаб у пациентов с болезнью Альцгеймера легкой и средней степени тяжести / не носители Apo_e4» (Клиническое испытание). Национальные институты здоровья США. 29 февраля 2008 г. Архивировано с оригинал 22 марта 2008 г.. Получено 23 марта 2008.
- ^ Сперлинг Р.А., Джек С.Р., Блэк С.Э., Фрош М.П., Гринберг С.М., Хайман Б.Т., Шелтенс П., Каррильо М.С., Тис В., Беднар М.М., Блэк Р.С., Брашир Г.Р., Грундман М., Симерс Е.Р., Фельдман Х.Х., Шиндлер Р.Дж. (июль 2011 г. ). «Связанные с амилоидом аномалии визуализации в терапевтических испытаниях, модифицирующих амилоид: рекомендации рабочей группы круглого стола по исследованиям Ассоциации Альцгеймера». Болезнь Альцгеймера и деменция. 7 (4): 367–85. Дои:10.1016 / j.jalz.2011.05.2351. ЧВК 3693547. PMID 21784348.
- ^ «Исследование безопасности, переносимости и эффективности для оценки субъектов с легкими когнитивными нарушениями» (Клиническое испытание). Национальные институты здоровья США. 11 марта 2008 г. Архивировано с оригинал 22 октября 2008 г.. Получено 23 марта 2008.
- ^ «Исследование по оценке безопасности, переносимости и эффективности PBT2 у пациентов с болезнью Альцгеймера на ранней стадии» (Клиническое испытание). Национальные институты здоровья США. 13 января 2008 г. Архивировано с оригинал 31 августа 2008 г.. Получено 23 марта 2008.
- ^ Исследования Etanercept:
- Тобиник Э (сентябрь 2009 г.). «Модуляция фактора некроза опухоли для лечения болезни Альцгеймера: обоснование и текущие данные». Препараты ЦНС. 23 (9): 713–25. Дои:10.2165/11310810-000000000-00000. PMID 19689163. S2CID 5267301.
- Тобиник Э, Гросс Х, Вайнбергер А, Коэн Х (апрель 2006 г.). «Модуляция TNF-альфа для лечения болезни Альцгеймера: 6-месячное пилотное исследование». МедГенМед. 8 (2): 25. ЧВК 1785182. PMID 16926764.
- Гриффин WS (январь 2008 г.). «Периспинальный этанерцепт: потенциал в качестве терапевтического средства против болезни Альцгеймера». Журнал нейровоспаления. 5: 3. Дои:10.1186/1742-2094-5-3. ЧВК 2241592. PMID 18186919.
- Тобиник Э (декабрь 2007 г.). «Периспинальный этанерцепт для лечения болезни Альцгеймера». Текущее исследование болезни Альцгеймера. 4 (5): 550–52. Дои:10.2174/156720507783018217. PMID 18220520.
- Ченг Х, Шен Й, Ли Р. (ноябрь 2014 г.). «Нацеливание на TNF: терапевтическая стратегия для болезни Альцгеймера». Открытие наркотиков сегодня. 19 (11): 1822–27. Дои:10.1016 / j.drudis.2014.06.029. PMID 24998784.
- ^ Вишик С.М., Бентам П., Вишик Д.И., Сенг К.М. (июль 2008 г.). «Терапия ингибитором агрегации тау (TAI) с rember TM останавливает прогрессирование болезни Альцгеймера легкой и средней степени тяжести в течение 50 недель». Болезнь Альцгеймера и деменция. 4 (4): Т167. Дои:10.1016 / j.jalz.2008.05.438. S2CID 54291555. Получено 30 июля 2008.
- ^ Харрингтон С., Рикард Дж, Хорсли Д. (июль 2008 г.). «Метилтиониния хлорид (MTC) действует как ингибитор агрегации тау (TAI) в клеточной модели и обращает вспять патологию тау в моделях болезни Альцгеймера на трансгенных мышах». Болезнь Альцгеймера и деменция. 4 (4): T120–21. Дои:10.1016 / j.jalz.2008.05.259. S2CID 54427606.
- ^ Дуди Р.С., Гаврилова С.И., Сано М., Томас Р.Г., Айсен П.С., Бачурин С.О., Сили Л., Хунг Д. (июль 2008 г.). «Влияние димебона на познание, повседневную деятельность, поведение и общие функции у пациентов с болезнью Альцгеймера от легкой до умеренной: рандомизированное, двойное слепое, плацебо-контролируемое исследование». Ланцет. 372 (9634): 207–15. Дои:10.1016 / S0140-6736 (08) 61074-0. PMID 18640457. S2CID 205951657.
- ^ Безпрозванный I (октябрь 2010 г.). «Взлет и падение Димебона». Новости и перспективы наркотиков (Оригинальная статья). 23 (8): 518–23. Дои:10.1358 / dnp.2010.23.8.1500435. ЧВК 3922928. PMID 21031168.
- ^ «Pfizer и Medivation объявляют о результатах двух исследований фазы 3 в рамках программы клинических исследований болезни Альцгеймера (NASDAQ: MDVN) с димебоном (латрепирдин *)» (Пресс-релиз). Архивировано из оригинал 4 сентября 2012 г.. Получено 16 ноября 2012.
- ^ Wendler A, Wehling M (март 2012 г.). «Оценка переводимости при разработке лекарств: восемь тематических исследований». Журнал трансляционной медицины. 10 (1): 39. Дои:10.1186/1479-5876-10-39. ЧВК 3330010. PMID 22397594.
- ^ Баддели Т.К., Маккаффри Дж., Стори Дж. М., Чунг Дж. К., Мелис В., Хорсли Д., Харрингтон К. Р., Вишик К. М. (январь 2015 г.). «Сложное расположение редокс-форм метилтиониния определяет эффективность терапии ингибиторами тау-агрегации при болезни Альцгеймера». Журнал фармакологии и экспериментальной терапии. 352 (1): 110–18. Дои:10.1124 / jpet.114.219352. PMID 25320049. S2CID 206501788.
- ^ Вишик К.М., Харрингтон К.Р., Стори Дж. М. (апрель 2014 г.). «Терапия ингибиторами тау-агрегации при болезни Альцгеймера». Биохимическая фармакология. 88 (4): 529–39. Дои:10.1016 / j.bcp.2013.12.008. PMID 24361915.
- ^ Feuerstein A (14 февраля 2017 г.). «Исследование лекарств компании Merck по борьбе с болезнью Альцгеймера прекращено досрочно из-за тщетности». Нью-Йорк: TheStreet, Inc. Архивировано с оригинал 16 февраля 2017 г.Изучение лекарств компании Merck Alzheimer прекращено досрочно из-за бесполезности Независимые наблюдатели пришли к выводу, что «практически не было шансов обнаружить положительный клинический эффект».
- ^ «После большой неудачи ученые и пациенты ищут новый вид лекарства от болезни Альцгеймера». NPR.org. Получено 17 мая 2019.
- ^ Галлахер, Джеймс (2 мая 2019 г.). «Деменция - величайшая проблема для здоровья'". Получено 17 мая 2019.
- ^ «Biogen планирует регистрацию нормативных документов для адуканумаба при болезни Альцгеймера на основе нового анализа большого набора данных из исследований фазы 3». 22 октября 2019.
- ^ Морли Дж. Э., Армбрехт Х. Дж., Фарр С. А., Кумар В. Б. (май 2012 г.). «Мышь с ускоренным старением (SAMP8) как модель окислительного стресса и болезни Альцгеймера». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1822 (5): 650–6. Дои:10.1016 / j.bbadis.2011.11.015. PMID 22142563.
- ^ Марчиняк Р., Шердова К., Цермакова П., Худечек Д., Сумек Р., Хорт Дж. (2014). «Влияние медитации на когнитивные функции в контексте старения и нейродегенеративных заболеваний». Границы поведенческой нейробиологии. 8: 17. Дои:10.3389 / fnbeh.2014.00017. ЧВК 3903052. PMID 24478663.
- ^ Larouche E, Hudon C, Goulet S (январь 2015 г.). «Возможные преимущества вмешательств на основе осознанности при легких когнитивных нарушениях и болезни Альцгеймера: междисциплинарная перспектива». Поведенческие исследования мозга. 276 (276): 199–212. Дои:10.1016 / j.bbr.2014.05.058. HDL:20.500.11794/39836. PMID 24893317. S2CID 36235259.
- ^ Яунмуктане З., Мид С., Эллис М. и др. (Сентябрь 2015 г.). «Доказательства передачи человеку патологии амилоида-β и церебральной амилоидной ангиопатии». Природа. 525 (7568): 247–50. Bibcode:2015Натура.525..247J. Дои:10.1038 / природа15369. PMID 26354483. S2CID 4465638.
- ^ Abbott A (сентябрь 2015 г.). «Вскрытие выявляет признаки болезни Альцгеймера у пациентов с гормоном роста». Природа. 525 (7568): 165–66. Bibcode:2015Натура.525..165A. Дои:10.1038 / 525165a. PMID 26354460. S2CID 2512394.
- ^ а б Мартин К., Солис Л., Конча М. И., Отт К. (июнь 2011 г.). «[Вирус простого герпеса типа 1 как фактор риска, связанный с болезнью Альцгеймера]» [Вирус простого герпеса типа 1 как фактор риска, связанный с болезнью Альцгеймера]. Revista Médica de Chile (на испанском). 139 (6): 779–86. Дои:10.4067 / S0034-98872011000600013. PMID 22051760.
- ^ Возняк М.А., Ми А.П., Ицхаки РФ (январь 2009 г.). «ДНК вируса простого герпеса типа 1 расположена в амилоидных бляшках болезни Альцгеймера». Журнал патологии (Оригинальное исследование). 217 (1): 131–38. Дои:10.1002 / путь.2449. PMID 18973185. S2CID 5176764.
- ^ Ицхаки РФ (2014). «Вирус простого герпеса типа 1 и болезнь Альцгеймера: все больше доказательств важной роли вируса». Границы старения нейронауки. 6: 202. Дои:10.3389 / fnagi.2014.00202. ЧВК 4128394. PMID 25157230.
- ^ Ицхаки Р.Ф., Токарный Р., Балин Б.Дж. и др. (2016). «Микробы и болезнь Альцгеймера». Журнал болезни Альцгеймера. 51 (4): 979–84. Дои:10.3233 / JAD-160152. ЧВК 5457904. PMID 26967229. Архивировано из оригинал 10 ноября 2016 г.
- ^ Алонсо Р., Пиза Д., Рабано А., Карраско Л. (июль 2014 г.). «Болезнь Альцгеймера и диссеминированные микозы». Европейский журнал клинической микробиологии и инфекционных заболеваний. 33 (7): 1125–32. Дои:10.1007 / s10096-013-2045-z. PMID 24452965. S2CID 14780610.
- ^ а б Пиза Д., Алонсо Р., Рабано А., Родал I, Карраско Л. (октябрь 2015 г.). «Различные области мозга заражены грибами при болезни Альцгеймера». Научные отчеты. 5: 15015. Bibcode:2015НатСР ... 515015П. Дои:10.1038 / srep15015. ЧВК 4606562. PMID 26468932.
- ^ "Гриб-призрак". Экономист. 22 октября 2015 г. Архивировано с оригинал 8 августа 2017 г.
- ^ Kumar DK, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, Lefkowitz A, McColl G, Goldstein LE, Tanzi RE, Moir RD (май 2016 г.). «Пептид амилоид-β защищает от микробной инфекции у мышей и червей на моделях болезни Альцгеймера». Научная трансляционная медицина. 8 (340): 340ra72. Дои:10.1126 / scitranslmed.aaf1059. ЧВК 5505565. PMID 27225182.
- ^ Колата, Джина (25 мая 2016 г.). «Может ли стебель Альцгеймера от инфекций? Это имеет смысл, говорят эксперты». Нью-Йорк Таймс. Архивировано из оригинал 4 февраля 2017 г.
- ^ «Виновник болезни Альцгеймера может бороться с другими заболеваниями». Новости науки. 16 июня 2016. Архивировано с оригинал 26 мая 2016 г.
- ^ Дугалл Нью-Джерси, Брюггинк С., Эбмайер КП (2004). «Систематический обзор диагностической точности 99mTc-HMPAO-SPECT при деменции». Американский журнал гериатрической психиатрии. 12 (6): 554–70. Дои:10.1176 / appi.ajgp.12.6.554. PMID 15545324.
- ^ Карпентер А.П., Понтекорво М.Ю., Хефти Ф.Ф., Сковронский Д.М. (август 2009 г.). «Использование исследовательского IND в оценке и разработке радиофармпрепаратов из 18F-ПЭТ для визуализации амилоида в головном мозге: обзор опыта одной компании». Ежеквартальный журнал ядерной медицины и молекулярной визуализации. 53 (4): 387–93. PMID 19834448.
- ^ Леунг К. (8 апреля 2010 г.). "(E) -4- (2- (6- (2- (2- (2- (18F-фторэтокси) этокси) этокси) пиридин-3-ил) винил) -N-метилбензоламин [[18F] AV-45] ". Молекулярная визуализация и база данных контрастных агентов. Архивировано из оригинал 7 июня 2010 г.. Получено 24 июн 2010.
- ^ Рабинович GD, Ягуст WJ (2009). «Амилоидная визуализация при старении и деменции: проверка амилоидной гипотезы in vivo». Поведенческая неврология. 21 (1): 117–28. Дои:10.1155/2009/609839. ЧВК 2804478. PMID 19847050. Архивировано из оригинал 30 июля 2013 г.
- ^ О'Брайен JT (декабрь 2007 г.). «Роль методов визуализации в диагностике деменции». Британский журнал радиологии. 80 Спец № 2 (Спец № 2): С71–77. Дои:10.1259 / bjr / 33117326. PMID 18445747.
- ^ «Группа FDA рекомендует условное одобрение для ПЭТ агента». Новости технологий обработки изображений. 21 января 2011 г.. Получено 17 июн 2019.
- ^ Кларк С.М., Шнайдер Дж. А., Беделл Б. Дж. И др. (Январь 2011 г.). «Использование флорбетапира-ПЭТ для визуализации патологии бета-амилоида». JAMA. 305 (3): 275–83. Дои:10.1001 / jama.2010.2008. ЧВК 7041965. PMID 21245183.
- ^ «Амивид». Регистр Сообщества лекарственных средств для использования человеком. Европейское сообщество. 17 января 2013 г.. Получено 18 апреля 2018.
- ^ Чонг М.С., Сахадеван С. (сентябрь 2005 г.). «Доклиническая болезнь Альцгеймера: диагностика и прогнозирование прогрессирования». Ланцет. Неврология. 4 (9): 576–79. Дои:10.1016 / с1474-4422 (05) 70168-х. PMID 16109364. S2CID 45448888.
- ^ а б Шарма Н., Сингх А.Н. (июль 2016 г.). «Изучение биомаркеров болезни Альцгеймера». Журнал клинико-диагностических исследований (Рассмотрение). 10 (7): KE01–06. Дои:10.7860 / JCDR / 2016 / 18828.8166. ЧВК 5020308. PMID 27630867.
- ^ Монтань А., Барнс С.Р., Суини М.Д. и др. (Январь 2015 г.). «Нарушение гематоэнцефалического барьера в стареющем гиппокампе человека». Нейрон. 85 (2): 296–302. Дои:10.1016 / j.neuron.2014.12.032. ЧВК 4350773. PMID 25611508.
- ^ Нация Д.А., Суини, доктор медицины, Монтань А. и др. (Февраль 2019). «Нарушение гематоэнцефалического барьера - ранний биомаркер когнитивной дисфункции человека». Природа Медицина. 25 (2): 270–276. Дои:10.1038 / s41591-018-0297-у. ЧВК 6367058. PMID 30643288.
- ^ Montagne A, Nation DA, Sagare AP и др. (Май 2020 г.). «APOE4 приводит к дисфункции гематоэнцефалического барьера, что предсказывает снижение когнитивных функций». Природа. 581 (7806): 71–76. Bibcode:2020Натура.581 ... 71M. Дои:10.1038 / с41586-020-2247-3. ЧВК 7250000. PMID 32376954.
дальнейшее чтение
| Библиотечные ресурсы о Болезнь Альцгеймера |
- Ирвин К., Законы КР, Гейл TM, Кондел Т.К. (2012). «Более сильное когнитивное ухудшение у женщин, чем у мужчин с болезнью Альцгеймера: метаанализ». Журнал клинической и экспериментальной нейропсихологии (Мета-анализ). 34 (9): 989–98. Дои:10.1080/13803395.2012.712676. PMID 22913619. S2CID 28300240.
- Харилал С., Хосе Дж., Парамби Д.Г., Кумар Р., Мэтью Г.Е., Уддин М.С. и др. (Сентябрь 2019 г.). «Достижения в области нанотерапевтических средств для лечения болезни Альцгеймера: текущие перспективы». Журнал фармации и фармакологии. 71 (9): 1370–1383. Дои:10.1111 / jphp.13132. PMID 31304982. S2CID 196616758.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
